题目内容
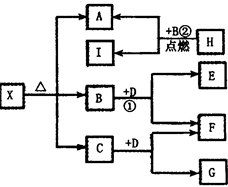
已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1:2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件已略去)。

请回答:.
(1)单质B的组成元素在周期表中的位置是 。
(2)戊的化学式为 。戊与强碱反应的离子方程式: 。
(3)NaClO的电子式为 。
(4)甲与水反应的化学方程式为 。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为: 。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536 kJ热量,其热化学方程式为: 。

请回答:.
(1)单质B的组成元素在周期表中的位置是 。
(2)戊的化学式为 。戊与强碱反应的离子方程式: 。
(3)NaClO的电子式为 。
(4)甲与水反应的化学方程式为 。
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为: 。
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1mol乙时放出536 kJ热量,其热化学方程式为: 。
(1)第2周期,第ⅤA族(各1分,共2分)
(2)Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O(各2分,共4分)
(3) (2分)
(2分)
(4)AlN+3H2O=Al(OH)3↓+NH3↑(2分)
(5)2NH3+NaClO=N2H4+NaCl+H2O(2分)
(6)4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s) △H=-1072 kJ/mol(2分)
(2)Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O(各2分,共4分)
(3)
 (2分)
(2分)(4)AlN+3H2O=Al(OH)3↓+NH3↑(2分)
(5)2NH3+NaClO=N2H4+NaCl+H2O(2分)
(6)4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s) △H=-1072 kJ/mol(2分)
试题分析:A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,戊为Al(OH)3;结合转化关系图可知,氢氧化铝分解生成氧化铝和水,则乙为氧化铝,所以A为Al;B为N2,甲为氮化铝,C为H2。
(1)组成B的元素为N元素,位于元素周期表中第2周期第ⅤA族。
(2)通过以上分析知,戊是氢氧化铝,其化学式为Al(OH)3,Al(OH)3与烧碱反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(3)NaClO是离子化合物,其电子式为
 。
。(4)根据转化图可知,氮化铝与水反应生成氢氧化铝和氨气,因此该反应的化学方程式为AlN+3H2O=Al(OH)3↓+NH3↑。
(5)反应②为氨气与NaClO的反应,0.5molNaClO参加反应时,转移1mol电子,则Cl元素化合价由+1价降低为-1价,即反应生成NaCl,同时生成N2H4和水,所以该反应的化学方程式为2NH3+NaClO=N2H4+NaCl+H2O。
(6)-定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),即Al、TiO2、C反应生成Al2O3、TiC。生成1molAl2O3时放出536kJ热量,则生成2molAl2O3时放出536kJ×2=1072热量,所以该反应热化学反应方程式为4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s) △H=-1072 kJ/mol。

练习册系列答案
相关题目

 Mn2++2H2O+Cl2↑
Mn2++2H2O+Cl2↑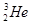 ,每百吨
,每百吨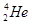 的形式存在。下列说法正确的是 ( )
的形式存在。下列说法正确的是 ( )