题目内容
工业废气NO、NO2是造成大气污染的气体之一,工业上常用原理为NOx + NH3→N2 + H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是( )
| A.1:1 | B.1:3 | C.3:1 | D.2:1 |
B
试题分析:在同温同压下,相同体积的任何气体含有相同数目的分子。由于该反应是氧化还原反应。所以还要符合电子守恒。因此可得方程式:12NOX+14NH3=13N2+21H2O.12X=21,所以X=1.75.假设NO、NO2的物质的量之比为:m:n,则(m+2n)÷(m+n)=1.75.解得m:n=1:3.所以选项为:B。

练习册系列答案
相关题目
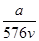 mol·L-1
mol·L-1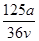 mol·L-1
mol·L-1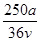 mol·L-1
mol·L-1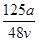 mol·L-1
mol·L-1