题目内容
NaCl是一种化工原料,可以制备一系列物质(如图所示)。下列说法正确的是
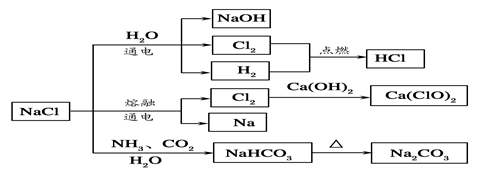

| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.如图所示转化反应不都是氧化还原反应 |
D
试题分析:A、25℃,NaHCO3在水中的溶解度比Na2CO3的小,错误;B、石灰乳和Cl2反应可制得漂白粉,其主要成分是次氯酸钙和氯化钙,有效成分是次氯酸钙,错误;C、常温下干燥的Cl2能用钢瓶贮存,所以Cl2常温下不与铁反应,在点燃或加热的条件下反应生成氯化铁,错误;D、如图所示转化反应如碳酸氢钠转化为碳酸钠,不是氧化还原反应,正确。

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目