题目内容
如图所示的电解装置中,乙池盛有20OmL饱和CuSO4溶液,丙池盛有2OOmL饱和NaCl溶液.通电一段时间后,C极增重0.64g,则: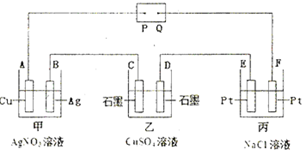
(1)P是电源的
(2)甲池中,A极的质量
(3)D极的电极反应式为
(4)电解后,乙、丙电池中溶液的pH分别为乙
(5)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度.则电解过程中转移电子的数目为

(1)P是电源的
负
负
极.(2)甲池中,A极的质量
增加
增加
(填“增加”或“减少”)2.16
2.16
g.电解一段时间,甲池溶液的pH不变
不变
(填“变大”、“变小”或“不变”).(3)D极的电极反应式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
,丙池电解反应的离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑
| ||
2Cl-+2H2O
2OH-+H2↑+Cl2↑
,相同状况下,D电极与E电极产生的气体体积比为
| ||
1:2
1:2
.(4)电解后,乙、丙电池中溶液的pH分别为乙
1
1
、丙13
13
(设溶液体积不变,温度为室温,也不考虑溶液的水解).(5)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度.则电解过程中转移电子的数目为
0.4NA
0.4NA
.(用NA表示)分析:乙池盛有20OmL饱和CuSO4溶液,C极增重0.64g,则C极发生Cu2++2e-=Cu,即C极为阴极,由图可知,P为负极,甲中发生Ag-e-=Ag+、Ag++e-=Ag;丙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑,乙中发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4;若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,则电解硫酸铜之后发生水的电解,以此来解答.
| ||
| ||
解答:解:(1)乙池盛有20OmL饱和CuSO4溶液,C极增重0.64g,则C极发生Cu2++2e-=Cu,即C极为阴极,由图可知,P为负极,故答案为:负;
(2)甲中A电极发生Ag++e-=Ag,则A电极质量增加,由Cu~2e-~2Ag,则Ag的质量为
×2×108g/mol=2.16g,硝酸银溶液的浓度不变,则pH不变,
故答案为:增加;2.16;不变;
(3)乙中D为阳极,发生的电极反应为4OH--4e-=2H2O+O2↑,丙中发生2NaCl+2H2O
2NaOH+H2↑+Cl2↑,其离子反应为2Cl-+2H2O
2OH-+H2↑+Cl2↑,E电极为氢气,
由电子守恒可知O2~2H2,则D电极与E电极产生的气体体积比为1:2,
故答案为:4OH--4e-=2H2O+O2↑;2Cl-+2H2O
2OH-+H2↑+Cl2↑;1:2;
(4)由电子守恒可知,乙中Cu~H2SO4,则c(H+)=
=0.1mol/L,其pH=1;由电子守恒可知丙中Cu~2NaOH,则c(OH-)=
=0.1mol/L,其pH=13,
故答案为:1;13;
(5)乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O
2Cu+O2↑+2H2SO4、2H2O
2H2↑+O2↑,
由Cu(OH)2
CuO+H2O,则转移的电子数为(0.1mol×2+0.1mol×2)×NA=0.4NA,故答案为:0.4NA.
(2)甲中A电极发生Ag++e-=Ag,则A电极质量增加,由Cu~2e-~2Ag,则Ag的质量为
| 0.64g |
| 64g/mol |
故答案为:增加;2.16;不变;
(3)乙中D为阳极,发生的电极反应为4OH--4e-=2H2O+O2↑,丙中发生2NaCl+2H2O
| ||
| ||
由电子守恒可知O2~2H2,则D电极与E电极产生的气体体积比为1:2,
故答案为:4OH--4e-=2H2O+O2↑;2Cl-+2H2O
| ||
(4)由电子守恒可知,乙中Cu~H2SO4,则c(H+)=
| 0.01mol×2 |
| 0.2L |
| 0.01mol×2 |
| 0.2L |
故答案为:1;13;
(5)乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度,发生2CuSO4+2H2O
| ||
| ||
由Cu(OH)2
| ||
点评:本题考查电解原理,明确通电一段时间后,C极增重是解答本题的突破口,熟悉电极的判断、发生的电极反应即可解答,并注意电子守恒的计算,题目难度中等.

练习册系列答案
 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
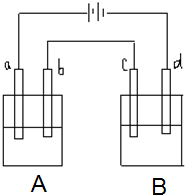 如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求: