题目内容
5.下列说法中正确的是( )| A. | 核外电子排布完全相同的两种微粒,其化学性质一定相同 | |
| B. | ⅠA和ⅦA元素单质从上到下,熔沸点逐渐升高,密度逐渐增大 | |
| C. | 一种离子和一种分子的质子数和电子数不可能同时相等 | |
| D. | 共价化合物溶于水过程中,共价键被破坏 |
分析 A.核外电子排布完全相同的两种微粒,可能为不同的分子;
B.ⅠA除H外为碱金属元素,随着原子序数的增大,熔沸点降低,而密度增大;而ⅦA元素单质为卤素单质,随着原子序数的增大,熔沸点升高,密度增大;
C.一种离子和一种分子的质子数可能相同,但电子数一定不同;
D.共价化合物溶于水过程中,可能不发生电离.
解答 解:A.核外电子排布完全相同的两种微粒,可能为不同的分子,如甲烷、氨气分子的化学性质不同,故A错误;
B.ⅠA除H外为碱金属元素,随着原子序数的增大,熔沸点降低,单质的密度呈增大趋势,但Na的密度大于K,而ⅦA元素单质为卤素单质,随着原子序数的增大,熔沸点升高,密度增大,故B错误;
C.因分子的质子数等于电子数,离子的质子数不等于电子数,则一种离子和一种分子的质子数可能相同,但电子数一定不同,故C正确;
D.共价化合物溶于水过程中,可能不发生电离,如乙醇溶于水,共价键不变,故D错误;
故选C.
点评 本题考查了化学键及元素周期律,为高频考点,把握化学键判断的一般规律及物质中化学键为解答的关键,选项B为解答的难点,注意规律性知识的归纳及应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.某同学在实验报告中有以下实验数据,其中数据合理的( )
①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用25mL酸式滴定管量出15.80mL的KMnO4溶液.
①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用25mL酸式滴定管量出15.80mL的KMnO4溶液.
| A. | ②③ | B. | ①③ | C. | ①④ | D. | 只有① |
16.铝合金是制造飞机、汽车等的常用材料.下列关子${\;}_{13}^{27}$Al的叙述正确的是( )
| A. | 质子数是27 | B. | 中子数是27 | C. | 电子数是13 | D. | 质量数是13 |
13.下列图标中表示易燃固体的是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列叙述正确的是( )
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 废电池需回收,主要是要利用电池外壳的金属材料 | |
| D. | 升高温度可降低活化能,增大反应速率 |
10.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是铯
②氧化性最强的是锂离子
③在自然界中均以化合态形式存在
④Li的密度最小
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+,Cs>Cs+.
①金属性最强的是铯
②氧化性最强的是锂离子
③在自然界中均以化合态形式存在
④Li的密度最小
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+,Cs>Cs+.
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
15.化合物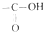 中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
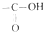 中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CCl4 | B. | CH3COF | C. | CH3COCH2Cl | D. | CH2ClCOOH |
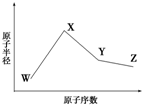 已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.

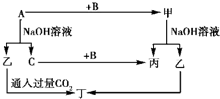 A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.
A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.