题目内容
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
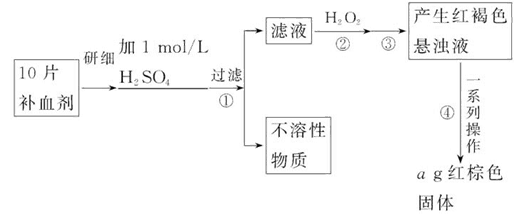
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加_______,该过程的现象为:__________________________________________。
(2)步骤②加入过量H2O2的目的是:____________________________________。
(3)步骤③中反应的离子方程式是:_____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______、灼烧、_______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加_______,该过程的现象为:__________________________________________。
(2)步骤②加入过量H2O2的目的是:____________________________________。
(3)步骤③中反应的离子方程式是:_____________________________________。
(4)步骤④中一系列处理的操作步骤:过滤、_______、灼烧、_______、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
(1)氯水(或双氧水、稀硝酸等合理氧化剂) 溶液由浅绿色变为红色
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3·H2O=Fe(OH)3↓+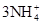 ]
]
(4)洗涤 冷却
(5)0.07a
(2)将Fe2+全部氧化为Fe3+
(3)Fe3++3OH-=Fe(OH)3↓[或Fe3++3NH3·H2O=Fe(OH)3↓+
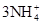 ]
](4)洗涤 冷却
(5)0.07a
(1)证明步骤①滤液中含有Fe2+的方法是:取样,先滴加KSCN溶液,再滴加氯水(或双氧水、稀硝酸等),若滤液由浅绿色变为红色,则说明滤液中含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是:将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是:将Fe3+全部转化为Fe(OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-=Fe(OH)3↓[或Fe3++ 3NH3·H2O=Fe(OH)3↓+
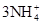 ]。
]。
(4)步骤④的目的是:将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④的操作步骤是:过滤、洗涤、灼烧、冷却、称量。
(5)由于实验中铁无损耗,根据铁元素守恒得,每片补血剂中m(Fe)=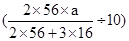 g="0.07a" g。
g="0.07a" g。
解答本题要注意两点:
(1)认真审题,避免由于审题不清,容易误算成“10片补血剂中含铁元素的质量”;
(2)在Fe3+存在的条件下,检验Fe2+的存在时,就不能采取先加KSCN溶液后加氯水等试剂的方法,而应采取加入适量酸性KMnO4溶液,若溶液由紫红色变为棕黄色,则含有Fe2+。
(2)由于H2O2具有氧化性,加入过量H2O2的目的是:将Fe2+全部氧化为Fe3+。
(3)步骤③的目的是:将Fe3+全部转化为Fe(OH)3,所以步骤③需加入过量的NaOH溶液或氨水,反应的离子方程式是:Fe3++3OH-=Fe(OH)3↓[或Fe3++ 3NH3·H2O=Fe(OH)3↓+

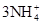 ]。
]。(4)步骤④的目的是:将产生的红褐色悬浊液分离,最终得到固体Fe2O3,所以步骤④的操作步骤是:过滤、洗涤、灼烧、冷却、称量。
(5)由于实验中铁无损耗,根据铁元素守恒得,每片补血剂中m(Fe)=
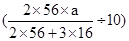 g="0.07a" g。
g="0.07a" g。解答本题要注意两点:
(1)认真审题,避免由于审题不清,容易误算成“10片补血剂中含铁元素的质量”;
(2)在Fe3+存在的条件下,检验Fe2+的存在时,就不能采取先加KSCN溶液后加氯水等试剂的方法,而应采取加入适量酸性KMnO4溶液,若溶液由紫红色变为棕黄色,则含有Fe2+。

练习册系列答案
相关题目

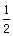 (a+b) mol
(a+b) mol