题目内容
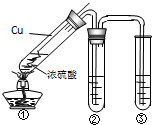
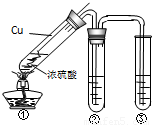
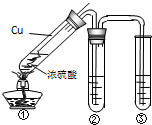
用如图所示实验装置进行物质性质探究实验.下列说法不合理的是
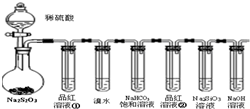
- A.若品红溶液①褪色,则说明产物中含有SO2
- B.若溴水褪色,则说明SO2具有还原性
- C.若烧瓶中产生黄色浑浊和无色气泡,则说明Na2S2O3只做氧化剂
- D.若品红溶液②不褪色、Na2SiO3溶液出现白色浑浊,则说明亚硫酸比碳酸酸性强
C
分析:A、硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫具有漂白性使品红褪色;
B、溴水褪色说明二氧化硫和溴水发生氧化还原反应,二氧化硫被溴单质氧化;
C、烧瓶中产生黄色浑浊和无色气泡是Na2S2O3和硫酸反应生成,硫代硫酸根离子中的硫元素在酸性条件下发生歧化反应,生成二氧化硫和硫沉淀;
D、若品红溶液②不褪色说明二氧化硫全部被吸收、Na2SiO3溶液出现白色浑浊,说明碳酸氢钠和二氧化硫反应生成二氧化碳气体,则说明亚硫酸比碳酸酸性强;
解答:A、硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫具有漂白性使品红褪色,若品红溶液①褪色,则说明产物中含有SO2,故A正确;
B、溴水褪色说明二氧化硫和溴水发生氧化还原反应,二氧化硫被溴单质氧化,表明二氧化硫具有还原性,故B正确;
C、硫代硫酸根离子中的硫元素在酸性条件下发生歧化反应,生成二氧化硫和硫沉淀;S2O32-+2H+═S↓+S02↑+H2O,说明Na2S2O3做氧化剂和还原剂,故C错误;
D、若品红溶液②不褪色说明二氧化硫全部被吸收、Na2SiO3溶液出现白色浑浊,说明碳酸氢钠和二氧化硫反应生成二氧化碳气体,则说明亚硫酸比碳酸酸性强;故D正确;
故选C.
点评:本题考查了实验方案的 设计和物质性质的验证方法和现象判断,物质性质的应用是解题关键,题目难度中等.
分析:A、硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫具有漂白性使品红褪色;
B、溴水褪色说明二氧化硫和溴水发生氧化还原反应,二氧化硫被溴单质氧化;
C、烧瓶中产生黄色浑浊和无色气泡是Na2S2O3和硫酸反应生成,硫代硫酸根离子中的硫元素在酸性条件下发生歧化反应,生成二氧化硫和硫沉淀;
D、若品红溶液②不褪色说明二氧化硫全部被吸收、Na2SiO3溶液出现白色浑浊,说明碳酸氢钠和二氧化硫反应生成二氧化碳气体,则说明亚硫酸比碳酸酸性强;
解答:A、硫酸和亚硫酸钠反应生成二氧化硫气体,二氧化硫具有漂白性使品红褪色,若品红溶液①褪色,则说明产物中含有SO2,故A正确;
B、溴水褪色说明二氧化硫和溴水发生氧化还原反应,二氧化硫被溴单质氧化,表明二氧化硫具有还原性,故B正确;
C、硫代硫酸根离子中的硫元素在酸性条件下发生歧化反应,生成二氧化硫和硫沉淀;S2O32-+2H+═S↓+S02↑+H2O,说明Na2S2O3做氧化剂和还原剂,故C错误;
D、若品红溶液②不褪色说明二氧化硫全部被吸收、Na2SiO3溶液出现白色浑浊,说明碳酸氢钠和二氧化硫反应生成二氧化碳气体,则说明亚硫酸比碳酸酸性强;故D正确;
故选C.
点评:本题考查了实验方案的 设计和物质性质的验证方法和现象判断,物质性质的应用是解题关键,题目难度中等.

练习册系列答案
相关题目
 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学. 化学是一门以实验为基础的自然科学.
化学是一门以实验为基础的自然科学.