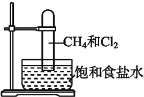
题目内容
【题目】航天飞船可用肼(N2H4)作动力源。已知1 g液态肼和足量的液态过氧化氢反应生成N2和水蒸气时放出20.05 kJ热量,化学方程式为N2H4+2H2O2=N2↑+4H2O。下列说法中错误的是 ( )
A. 肼(N2H4)分子中只存在极性共价键
B. 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ
C. 该反应中肼作还原剂
D. 该反应的反应物总能量高于生成物的总能量
【答案】A
【解析】
A. 肼中存在NH极性键,也有NN非极性键,结构简式为![]() ,A项错误;
,A项错误;
B.1g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05kJ的热量,则1mol肼反应放出的热量为32×20.05 kJ =641.6 kJ,B项正确;
C. N2H4中N元素为2价,反应后生成N2为0价,所以N元素化合价升高,所以肼作还原剂,C项正确;
D.反应放热,所以反应物的总能量高于生成物的总能量,D项正确;
答案选A。

练习册系列答案
相关题目