题目内容
已知甲、乙、丙、X、Y为中学化学常见物质,其中甲、乙、丙中均含有元素A,其转化关系如图所示(反应条件已省略):

(1)若甲是可用于自来水消毒的黄绿色气体,X的水溶液通入二氧化碳能产生白色沉淀,则反应①的用途为
(2)若甲是空气中含量最高的气体,乙的密度小于丙,则一定条件下,反应③的化学方程式为
(3)若A是短周期元素,其主族数是周期数的两倍.若甲是单质,乙是氧化物且能使品红褪色,则反应③的化学方程式为

(1)若甲是可用于自来水消毒的黄绿色气体,X的水溶液通入二氧化碳能产生白色沉淀,则反应①的用途为
漂白粉
漂白粉
(填一种).(2)若甲是空气中含量最高的气体,乙的密度小于丙,则一定条件下,反应③的化学方程式为
4NH3+6NO
5N2+6H2O
| ||
4NH3+6NO
5N2+6H2O
.
| ||
(3)若A是短周期元素,其主族数是周期数的两倍.若甲是单质,乙是氧化物且能使品红褪色,则反应③的化学方程式为
SO2+2H2S=3S↓+2H2O
SO2+2H2S=3S↓+2H2O
.分析:(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,则丙应呈酸性;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应;
(3)A是短周期元素,其主族数是周期数的两倍,应为S元素,乙是氧化物且能使品红褪色,则应为SO2,则丙应为H2S.
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应;
(3)A是短周期元素,其主族数是周期数的两倍,应为S元素,乙是氧化物且能使品红褪色,则应为SO2,则丙应为H2S.
解答:解:甲、乙、丙中均含有元素A,乙和丙中都含有A元素,二者的反应为归中反应,
(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,反应①常用于制备漂白粉,
故答案为:漂白粉;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应,反应的方程式为4NH3+6NO
5N2+6H2O,
故答案为:4NH3+6NO
5N2+6H2O;
(3)A是短周期元素,其主族数是周期数的两倍,应为S元素,乙是氧化物且能使品红褪色,则应为SO2,则丙应为H2S,二者反应的方程式为SO2+2H2S=3S↓+2H2O,
故答案为:SO2+2H2S=3S↓+2H2O.
(1)甲是可用于自来水消毒的黄绿色气体,应为Cl2,X的水溶液通入二氧化碳能产生白色沉淀,可为Ca(OH)2,乙为Ca(Cl)2和CaCl2的混合物,乙和丙反应生成Cl2,反应①常用于制备漂白粉,
故答案为:漂白粉;
(2)甲是空气中含量最高的气体,应为N2,乙和丙中都含有N元素,二者的反应为归中反应,应为NH3和NO的反应,反应的方程式为4NH3+6NO
| ||
故答案为:4NH3+6NO
| ||
(3)A是短周期元素,其主族数是周期数的两倍,应为S元素,乙是氧化物且能使品红褪色,则应为SO2,则丙应为H2S,二者反应的方程式为SO2+2H2S=3S↓+2H2O,
故答案为:SO2+2H2S=3S↓+2H2O.
点评:本题考查无机物的推断,题目难度中等,本题注意根据物质的性质、用途、含量以及原子结构等特点作为突破口,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
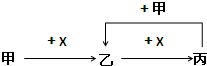 已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )| A、甲为C,X为O2 | B、甲为SO2,X为NaOH溶液 | C、甲为Fe,X为Cl2 | D、甲为AlCl3,X为NaOH溶液 |
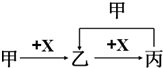 已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )
已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系如图.甲和X不可能是( )| A、甲为C,X为O2 | B、甲为Fe,X为Cl2 | C、甲为SO2,X为NaOH溶液 | D、甲为Cl2,X为Fe |
 已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图.
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系符合如图. 已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )
已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如图,则甲和X不可能是( )