题目内容
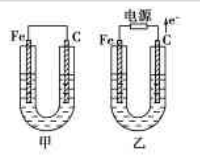 甲、乙两池电极材料如图所示.
甲、乙两池电极材料如图所示.请按要求回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:①有红色物质析出的是:甲池中的
碳
碳
棒(填“铁”或“碳”)、乙池中的阴
阴
极(填“阴”或“阳”);②乙池中阳极电极反应式是
4OH-4e-=2H2O+O2↑
4OH-4e-=2H2O+O2↑
.(2)若两池中均为足量饱和NaCl溶液:
①写出乙池中总反应的化学方程式
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
;
| ||
若电极上转移0.2mole-,则阴极上生成
0.1
0.1
mol气体;再加入HCl
HCl
(填化学式)可恢复到原来浓度.②甲池中碳极上电极反应式是
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
,其原理与金属的吸氧
吸氧
腐蚀原理相同;若要防止铁的腐蚀可采取的措施为b、c
b、c
(填序号).a.将甲图碳棒换成铜棒
b.碳棒换成锌棒
c.在铁、碳之间连接一个直流电源,把铁接到负极上
d.把铁接到直流电源的正极上.
分析:甲池为原电池,乙池为电解池.原电池中活泼金属做负极,发生氧化反应,碳棒做正极,发生还原反应;电解池中外电路电子流向电源正极,所以碳棒为阳极发生氧化反应,铁为阴极发生还原反应,由离子放电顺序知阳极氢氧根放电生成氧气,阴极铜离子的电子生成铜;恢复电解池溶液的浓度原则加入氧化铜.
解答:解:(1)①甲池为原电池,原电池中活泼金属做负极,发生氧化反应,碳棒做正极,有Cu析出,乙池为电解池,阴极发生还原反应有Cu析出,故答案为:碳;阴;
②电解质溶液中的铜离子在原电池正极析出,在电解池阴极析出;惰性电极电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH-4e-=2H2O+O2↑,
故答案为:4OH-4e-=2H2O+O2↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极电解氯化钠溶液,方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,
若电极上转移0.2mole-,则阴极生成0.1mol氢气,阳极生成0.1mol氯气,若要恢复电解质溶液浓度,只需加入0.2molHCl即可,
故答案为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;0.1mol;HCl;
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,用电化学方法防止金属腐蚀就要让被保护的金属做原电池的正极或电解池的阴极.
故答案为:O2+2H2O+4e-=4OH-;吸氧;b、c.
②电解质溶液中的铜离子在原电池正极析出,在电解池阴极析出;惰性电极电解硫酸铜溶液,阳极氢氧根离子放电生成氧气,电极反应为4OH-4e-=2H2O+O2↑,
故答案为:4OH-4e-=2H2O+O2↑;
(2)①若电解质溶液为饱和氯化钠溶液,则乙池就是用惰性电极电解氯化钠溶液,方程式为2NaCl+2H2O
| ||
若电极上转移0.2mole-,则阴极生成0.1mol氢气,阳极生成0.1mol氯气,若要恢复电解质溶液浓度,只需加入0.2molHCl即可,
故答案为:2NaCl+2H2O
| ||
②甲池中碳棒为正极,发生还原反应,氧气得到电子生成氢氧根,与吸氧腐蚀的电极反应相同,用电化学方法防止金属腐蚀就要让被保护的金属做原电池的正极或电解池的阴极.
故答案为:O2+2H2O+4e-=4OH-;吸氧;b、c.
点评:本题主要考查电化学反应原理,要明确不同电解质所发生的电极反应,熟悉原电池和电解池的工作原理即可解答.

练习册系列答案
相关题目
(10分)甲、乙两池电极材料如图所示,请按要求回答下列问题:
|
②乙池碳极上电极反应属于___________(填氧化反应、还原反应)。
③乙池中阳极上发生的电极反应方程式是 _________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式 。
②甲池中碳极上电极反应方程式是 。
③若乙池中饱和NaCl溶液100 mL一段时间后在阴极得到112 mL(标准状况)H2,此时乙池溶液的(体积变化忽略不计)pH为__________
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①阳电极的材料是____________
②阴极反应式是 。(说明:杂质发生的电极反应不必写出)
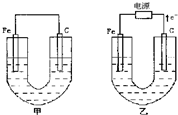 甲、乙两池电极材料如图所示,请按要求回答下列问题:
甲、乙两池电极材料如图所示,请按要求回答下列问题: