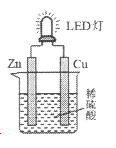
题目内容
【题目】现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.
A元素原子的核外p电子数比s电子数少3 |
B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具 |
C元素基态原子p轨道有3个未成对电子 |
D原子核外所有p轨道全满或半满 |
E在该周期中未成对电子数最多 |
F能形成红色(或砖红色)和黑色的两种氧化物 |
某同学根据上述信息,推断
(1)画出A基态原子的核外电子排布图____________________。
(2)B基态原子的核外电子排布图![]() , 该同学所画的电子排布图违背了____________________________________。
, 该同学所画的电子排布图违背了____________________________________。
(3)D基态原子中能量最高的电子,其电子云在空间有____________个方向,原子轨道呈____________形。
(4)写出C原子的电子排布式 ____________;写出E原子的电子简化排布式____________。
(5)请写出F元素价电子排布式________________________。
【答案】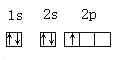 洪特规则 3 哑铃 1s22s22p3 [Ar]3d54s1 3d104s1
洪特规则 3 哑铃 1s22s22p3 [Ar]3d54s1 3d104s1
【解析】
A、B、C、D、E为短周期主族元素,原子序数依次增大,A元素原子的核外p电子数比s电子数少3,电子排布式为1s22s22p1,即A为B元素;B元素形成的物质种类繁多.其形成的一种固体单质工业上常用作切割工具,则B为C元素;C元素基态原子p轨道有3个未成对电子,价电子排布式为ns2np3,D原子核外所有p轨道全满或半满,结合原子序数可知,价电子排布式为3s23p3符合题意,即C为N元素、D为P元素;E在该周期中未成对电子数最多,则E为第四周期元素,第四周期元素中未成对电子数最多的原子应该是3d能级上容纳5个电子、4s能级容纳1个电子,其外围电子排布式为3d54s1,则E为Cr元素;F能形成红色(或砖红色)和黑色的两种氧化物,即F为Cu元素。
(1)A为B元素,基态B原子的电子排布式为1s22s22p1,则核外电子排布图为 ,故答案为:
,故答案为: ;
;
(2)B为C元素,基态原子的核外电子排布式为1s22s22p2,由洪特规则可知,电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同,则题给基态原子的核外电子排布图违反了洪特规则,故答案为:洪特规则;
(3)D为P元素,基态P原子的核外电子排布式为1s22s22p63s23p3,3p能级上电子能量最高,3p电子云在空间有3个伸展方向,原子轨道呈哑铃或纺锤形,故答案为:哑铃;
(4)C为N元素,N原子的电子排布式为1s22s22p3;E为Cr元素,Cr原子的电子简化排布式为[Ar]3d54s1,故答案为:1s22s22p3;[Ar]3d54s1;
(5)F为Cu元素,Cu原子电子排布式为[Ar]3d104s1,价电子排布式为3d104s1,故答案为:电子排布式为3d104s1。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某温度下,在 2 L 恒容密闭容器中 3 种物质间进行反应,X、Y、Z 的物质的量随时间的变化曲线如图所示,反应在 t1 min 时达到平衡。

(1)请写出该反应的化学方程式:_____。
(2)若上述反应中X、Y、Z 分别为 NH3、H2、N2,在此 t1 min 时间内,用H2 表示该反应的平均速率 v(H2)为_____。
(3)拆开 1mol 共价键所需吸收的能量如下表:
共价键 | H-H | N≡N | N-H |
吸收的能量/kJ | 436 | 946 | 391 |
1mol N2 完全反应为NH3_____(填:吸收或放出)_____kJ 能量。事实上,将 1molN2 和3molH2 放在反应容器中,使它们充分反应,反应的热量变化总小于计算值,原因是_________。
(4)下列叙述能判断该反应达到平衡状态的是_____(填字母代号)。
A 容器内各气体组分的质量分数不再发生改变
B 正反应速率与逆反应速率相等
C 容器内气体的密度不再发生改变
D 混合气体的平均相对分子质量不再发生改变
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
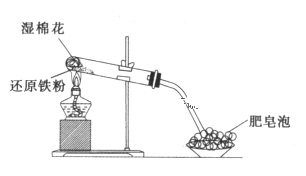
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |