题目内容
5. 燃煤烟气脱硫有很多方法
燃煤烟气脱硫有很多方法方法I:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4.
方法II:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4.
据此回答以下问题:
(1)方法I中发生氧化还原反应的离子方程式2HSO3-+O2═2SO42-+2H+.能提高方法I燃煤烟气SO2中去除率的措施有A、D(填字母).
A.增大氨水浓度 B.增大燃煤烟气的流速
C.事先去除燃煤烟气中的二氧化碳 D.增大压强
(2)采用方法II脱硫,燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液反应不能,亚硫酸的酸性大于碳酸(说明理由).已知H2SO3为的电离平衡常数为K1=1.54×10-2,K2=1.02×10-7.则NaHSO3溶液中含S元素粒子浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3).通过右图所示电解装置可将生成的NaHSO3转化为硫酸,电极材料皆为石墨.则A为电解池的阴极(填“阴极”或“阳极”).C为较浓的硫酸溶液(填物质名称).若将阴离子交换膜换成阳子交换膜,写出阳极区域发生的电极反应2H2O-4e-═O2↑+4H+.
分析 (1)方法I为:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4,发生氧化还原反应的一步是入空气将NH4HSO3氧化成(NH4)2SO4,据此写出反应的离子方程式,结合可逆反应的影响化学平衡的条件,以及改变转化率的方法,据此分析;
(2)采用方法II脱硫,方法II为:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4,考虑H2SO3和H2CO3的酸性强弱,反应应又强酸制取弱酸,根据H2SO3的电离平衡常数分析比较粒子浓度大小,A电极产生H2,注意到A处NaHSO3变成了Na2SO3,则可判断H2由H+得到电子而来,电解池中阴极反应为物质得到电子,发生还原反应,根据电极反应分析C处的溶液性质,电解池阳极发生的反应为物质失去电子,发生氧化反应,据此写出阳极的电极反应.
解答 解:(1)方法I为:先用氨水将SO2转化为NH4HSO3,再通入空气氧化成(NH4)2SO4,发生氧化还原反应的一步是入空气将NH4HSO3氧化成(NH4)2SO4,则方法I中发生氧化还原反应的离子方程式为:2HSO3-+O2=2SO42-+2H+,
方法I中涉及到的反应有:SO2+NH3•H2O═NH4HSO3,这一步就是除去SO2的步骤,
A.增大氨水浓度,可使SO2的吸收率增大,反应转化的更彻底,可以有效提高SO2中去除率,故A选;
B.增大燃煤烟气的流速,去除反应是靠溶液吸收,增大燃煤烟气的流速会使溶液吸收率降低,不能很有效的去除SO2,应该减缓燃煤烟气的流速,故B不选;
C.用氨水溶液吸收,氨水溶液可以吸收CO2,不必要事先去除燃煤烟气中的二氧化碳,故C不选;
D.从可逆反应角度考虑,反应SO2+NH3•H2O═NH4HSO3为气体数减少的反应,随着反应进行,体系压强降低,增大压强有利于反应向正反应方向进行,可以提高燃煤烟气SO2中去除率,故D选,故选AD,
故答案为:2HSO3-+O2=2SO42-+2H+;A、D;
(2)采用方法II脱硫,方法II为:用Na2SO3溶液吸收SO2,再经电解转化为H2SO4,考虑H2SO3和H2CO3的酸性强弱为H2SO3>H2CO3,则燃煤烟气中的二氧化碳能否与生成的NaHSO3溶液不能反应生成H2SO3,理由为:亚硫酸的酸性大于碳酸,
NaHSO3溶液中含S元素粒子有:HSO3-,SO32-,H2SO3,根据H2SO3的电离平衡常数:K1=1.54×10-2,K2=1.02×10-7,对于NaHSO3溶液,SO32-由反应:HSO3-?H++SO32-而来,该反应的平衡常数为K2=1.02×10-7,H2SO3由反应:HSO3-+H2O?H2SO3+OH-而来,该反应的平衡常数为Kb=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{1.54×1{0}^{-2}}$=6.58×10-13,通过平衡常数比较反应趋势,无论是HSO3-水解还是电离,趋势都比较小,所以含S粒子中,HSO3-的离子浓度最大,由K2>>Kb,则HSO3-的电离趋势比较大,则平衡时SO32-的浓度大于H2SO3,综上,NaHSO3溶液中含S元素粒子浓度由大到小的顺序为:c(HSO3-)>c(SO32-)>c(H2SO3),
根据电解装置图分析,A电极产生H2,注意到A处NaHSO3变成了Na2SO3,则可判断H2由H+得到电子而来,电解池中阴极反应为物质得到电子,发生还原反应,则A为电解池的阴极,
B处阳极,电解池阳极的反应为物质失去电子,发生氧化反应,也产生气体,则阳极的电子反应为:2H2O-4e-═O2↑+4H+,考虑到电解池中,阴离子向阳极移动,且装置中存在阴离子交换膜,则阴极的HSO3-,SO32-可以通过阴离子交换膜到达阳极经过反应生成SO42-,无疑随着电解反应的进行,阳极的硫酸浓度会增大,则C处会排出较浓的硫酸,所以C为:较浓的硫酸,
若将阴离子交换膜换成阳子交换膜,阳极发生的反应为:2H2O-4e-═O2↑+4H+,考虑到电解池中阳离子向阴极移动,所以阳极产生的H+会通过阳离子交换膜向阴极移动,考虑到阳极是硫酸,电解反应写成OH-放电是不恰当的,应为2H2O-4e-═O2↑+4H+,
故答案为:不能,亚硫酸的酸性大于碳酸;c(HSO3-)>c(SO32-)>c(H2SO3);阴极;较浓的硫酸溶液;2H2O-4e-=O2↑+4H+.
点评 本题考查电解原理,涉及到氧化还原反应方程式的书写和配平,可逆反应的知识迁移,弱电解质的电离平衡,粒子浓度大小的比较,电极反应式的书写,根据溶液的介质写恰当的电极反应式,知识点均为重点和高频考点,题目难度中等.

 已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示.下列说法错误的是( )
已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间的转化关系如图所示.下列说法错误的是( )| A. | 若E、D的水溶液均呈酸性,则A为硫 | |
| B. | 若D是一种难溶于水的物质,则A为硅 | |
| C. | 若E、D的水溶液均呈酸性,则B能与水反应 | |
| D. | 若D是一种难溶于水的物质,则B能与水反应 |
| A. | 溶液中的溶质粒子能透过滤纸,而胶体中的分散质粒子不能透过滤纸,所以可以用滤纸来分离溶液和胶体 | |
| B. | 有化学键断裂或化学键形成的过程都是化学变化 | |
| C. | 焰色反应属于吸热反应 | |
| D. | 食盐溶液能导电,但食盐溶液不是电解质 |
| A. | 纤维素 脂肪 | B. | 蛋白质 油脂 | C. | 蛋白质 液态烃 | D. | 纤维素 液态烃 |
 以熔融CaF2-CaO作电解质,用下图所示袋置获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
以熔融CaF2-CaO作电解质,用下图所示袋置获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 整套装置工作前后中CaO的总量基本不变 | |
| B. | 阳极的电极反应式为2Ca2++4e-=2Ca | |
| C. | 石墨电极作阳极,质量不变 | |
| D. | 电解过程中,F-和O2-向阴极移动 |
| A. | 水分子的结构式: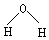 | B. | 氯原子的结构示意图: | ||
| C. | 溴化钠的电子式: | D. | 氮气的电子式: |
| A. | 反应后混合气体的平均相对分子质量为35.2 | |
| B. | 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1:1 | |
| C. | 将混合气体通入溴的四氯化碳溶液,溶液增重128g | |
| D. | 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol |


 .
.