题目内容
某溶液可能含有Clˉ、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
| A.至少存在5种离子 |
| B.Clˉ一定存在,且c(Clˉ)≥0.4mol/L |
| C.SO42ˉ、NH4+一定存在,Clˉ可能不存在 |
| D.CO32ˉ、Al3+一定不存在,K+可能存在 |
B
解析试题分析:加入氢氧化钠得到0.02mol气体,气体为氨气,说明有铵根离子0.02mol;红褐色沉淀灼烧得到1.6g固体,固体为氧化铁,物质的量为0.01mol,说明含Fe3+0.02mol;加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀,说明含有SO42-,物质的量为0.02mol;根据电荷守恒:c(SO42-)×2<c(Fe3+)×3+c(NH4+),所以溶液中还有阴离子,由于CO32-不会与Fe3+共存,所以只能是Clˉ,物质的量为0.04mol,溶液中可能还有其他阳离子,所以Clˉ物质的量≥0.04mol,溶液的体积为100mL,所以c(Clˉ)≥0.4mol/L。
考点:考查分散系。

下列化学用语或模型表示不正确的是
A.中子数为14的硅原子: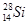 |
B.CH4分子的比例模型: |
C.聚乙烯的结构简式: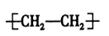 |
| D.次氯酸分子的结构式:H—O-Cl |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下,NO2和N2O4的混合物46g中含有2NA个氧原子 |
| B.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| C.10mL98%的浓H2SO4用水稀释至l00mL,H2SO4的质量分数为9.8% |
| D.标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO42-的物质的量浓度为( )
| A.0.4 mol·L-1 | B.0.3 mol·L-1 |
| C.0.2 mol·L-1 | D.0.1 mol·L-1 |
某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析正确的是( )
| 盐酸/mL | 50 | 50 | 50 |
| m(混合物)/g | 9.2 | 15.7 | 27.6 |
| V(CO2)(标准状况)/L | 2.24 | 3.36 | 3.36 |
A.盐酸的物质的量浓度为3.2 mol·L-1
B.混合物中NaHCO3的质量分数为54.3%
C.9.2 g混合物中KHCO3的物质的量为0.05 mol
D.15.7 g混合物恰好与盐酸完全反应
要配制物质的量浓度约为2 mol·L-1的NaOH溶液100 mL,下面的操作正确的是( )
| A.称取7.8 g Na2O2固体,放入250 mL烧杯中,用100 mL 量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 |
| B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL |
| C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 |
| D.用100 mL量筒量取40 mL 5 mol·L-1NaOH溶液,倒入250 mL烧杯中,再用另一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
下列关于物质的量的叙述中,正确的是( )。
| A.1 mol任何物质都含有6.02×1023个分子 |
| B.0.012 kg12C中含有约6.02×1023个碳分子 |
| C.1 mol水中含有2 mol氢和1 mol氧 |
| D.1 mol Ne中含有6.02×1024个电子 |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用图所示装置加热硫酸铜粉末直至完全分解。硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如下表所示。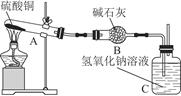
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑ B. 3CuSO4
 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑ D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑ 某混合气体X,可能由H2、CO、CO2和水蒸气中的一种或几种组成,现将混合气体通入灼热的CuO,完全反应后,固体 CuO质量减少1.6 g;再将反应后的混合气体全部导入足量的澄清石灰水中,生成白色沉淀10 g。根据以上信息,分析下列有关X的组成推断正确的是( )
| A.X一定只由CO组成 |
| B.X一定只由H2和CO2组成 |
| C.X可能由0.1 g H2和4.4 g CO2组成 |
| D.X可能由0.1 g H2、1.4 g CO、2.2 g CO2组成 |