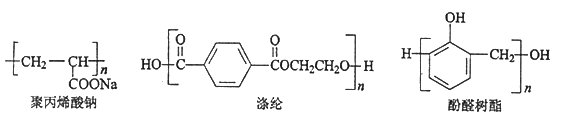
题目内容
【题目】NA为阿伏伽德罗常数,下列叙述正确的是( )
A. 室温下,lLpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
B. 标准状况下,2.24LCl2通入水中充分反应,转移电子数目0.1NA
C. 常温常压下,42g乙烯和丁烯混合气体中,含原子数目为9NA
D. 氢氧燃料电池正极消耗22.4L (标准状况)气体时,电路中通过的电子数目为2NA
【答案】C
【解析】A、1LpH=13的NaOH溶液中由水电离的OH-离子数目为10-13NA,选项A错误;B、虽然Cl2+H2O![]() HClO+HCl~e—中转移电子的物质的量与氯气的系数之比相等,但氯气部分与水反应,且反应是不能进行到底的可逆反应,说明2.24LCl2通入水中充分反应,转移电子数目不可能为0.1NA,选项B错误;C、42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有9mol原子,选项C正确;D、氢氧燃料电池正极消耗22.4L氧气(标准状况)气体时,电路中通过和电子数目为4NA,选项D错误。答案选C。
HClO+HCl~e—中转移电子的物质的量与氯气的系数之比相等,但氯气部分与水反应,且反应是不能进行到底的可逆反应,说明2.24LCl2通入水中充分反应,转移电子数目不可能为0.1NA,选项B错误;C、42g乙烯和丁烯的混合物中含有3mol最简式CH2,含有9mol原子,选项C正确;D、氢氧燃料电池正极消耗22.4L氧气(标准状况)气体时,电路中通过和电子数目为4NA,选项D错误。答案选C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸