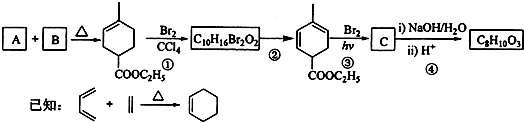
题目内容
【题目】某学生为了探究钠与CO2的反应,利用如图装置进行实验.(已知PdCl2能被CO还原得到黑色的Pd)
(1)请将上图各装置连接完整(填写装置中序号)→→→→ .
(2)若用稀盐酸与CaCO3反应制备CO2 , 在加稀盐酸时,发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向装置②长颈漏斗中加入的试剂是 .
A.CCl4
B.H2SO4溶液
C.硝酸钠溶液
D.植物油
(3)检查装置②的气密性,方法是 . 装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让CO2充满整个装置,当观察到时再点燃酒精灯.装置④的作用 .
(4)通入CO2的量不同可能会导致生成的产物不同.假如反应过程中有下列两种情况,按要求分别写出两种情况时的化学方程式.I.当装置⑤PdCl2溶液中观察到有黑色沉淀产生,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,写出此情况时钠与CO2反应的化学方程式 .
II.当装置①中钠的质量为0.23g时,充分反应后,将装置①中的固体加入到足量稀盐酸中,产生112mL的CO2气体(标况下测定),装置⑤PdCl2溶液中没有观察到黑色沉淀产生,写出此情况时钠与CO2反应的化学方程式 .
【答案】
(1)②;④;③;①;⑤
(2)AC
(3)用弹簧夹夹住C处橡皮管,向装置②中加水至长颈漏斗液面高于试管液面,且长时间液面差稳定;装置⑤中澄清石灰水变浑浊;排尽装置中空气,以免空气中O2、CO2、H2O干扰实验;除去二氧化碳中氯化氢气体
(4)2Na+2CO2 ![]() Na2CO3+CO;4Na+3CO2
Na2CO3+CO;4Na+3CO2 ![]() 2Na2CO3+C
2Na2CO3+C
【解析】解:(1)根据实验目的,先需要准备二氧化碳,选用二氧化碳发生装置为②,为了便于控制反应,选用的药品是块状碳酸钙,所以只能选用稀盐酸,生成的二氧化碳中混有氯化氢氢气,需要经过装置④饱和碳酸氢钠溶液除去杂质氯化氢,然后干燥二氧化碳,选用装置③浓硫酸,干燥后的二氧化碳通入装置①与金属钠反应,反应后的气体利用装置⑤检验,所以正确的连接顺序为:c→f→g→d→e→a→b→h→i,装置中序号为②④③①⑤,所以答案是:②;④;③;①;⑤;(2)发现CaCO3与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,则A.CCl4密度比水大,且不反应,可使盐酸与碳酸钙接触,故A正确; B.H2SO4溶液与碳酸钙反应生成硫酸钙,不利于气体的制备,故B错误;C.硝酸钠溶液使溶剂增多,碳酸钙与盐酸接触,故C正确; D.植物油的密度比水的密度小,可使碳酸钙与盐酸分离,故D错误;所以答案是:AC;(3)检查装置②的气密性,方法是用弹簧夹夹住C处橡皮管,向装置②中加水至长颈漏斗液面高于试管液面,且长时间液面差稳定;反应开始前,需要排尽装置中空气,以免空气中O2、CO2、H2O干扰实验,装置⑤中左端试管中澄清石灰水变浑浊,且导管口产生均匀气泡,开始点燃酒精灯;装置④的作用为除去二氧化碳中氯化氢气体,所以答案是:用弹簧夹夹住C处橡皮管,向装置②中加水至长颈漏斗液面高于试管液面,且长时间液面差稳定;装置⑤中澄清石灰水变浑浊;排尽装置中空气,以免空气中O2、CO2、H2O干扰实验;除去二氧化碳中氯化氢气体;(4)I.装置⑤PdCl2溶液中观察到有黑色沉淀,说明反应生成了一氧化碳;装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,说明生成的固体是碳酸钠,钠与二氧化碳反应生成了碳酸钠和一氧化碳,反应的化学方程式为2Na+2CO2 ![]() Na2CO3+CO,所以答案是:2Na+2CO2
Na2CO3+CO,所以答案是:2Na+2CO2 ![]() Na2CO3+CO;II.钠的质量为0.46g,钠的物质的量为0.02mol;反应装置⑤中无现象,说明没有生成一氧化碳和二氧化碳气体;充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,二氧化碳的物质的量为0.01mol,含有碳酸根离子0.01mol,钠与碳酸根离子物质的量为2:1,说明生成了碳酸钠固体;溶液中还有固体残留,说明有固体碳生成,根据以上分析,钠与二氧化碳反应生成了碳酸钠和碳,反应的化学方程式为4Na+3CO2
Na2CO3+CO;II.钠的质量为0.46g,钠的物质的量为0.02mol;反应装置⑤中无现象,说明没有生成一氧化碳和二氧化碳气体;充分反应后,将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,二氧化碳的物质的量为0.01mol,含有碳酸根离子0.01mol,钠与碳酸根离子物质的量为2:1,说明生成了碳酸钠固体;溶液中还有固体残留,说明有固体碳生成,根据以上分析,钠与二氧化碳反应生成了碳酸钠和碳,反应的化学方程式为4Na+3CO2 ![]() 2Na2CO3+C,所以答案是:4Na+3CO2
2Na2CO3+C,所以答案是:4Na+3CO2 ![]() 2Na2CO3+C.
2Na2CO3+C.

 名校课堂系列答案
名校课堂系列答案【题目】在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0~20 s内,v(NO2)=0.005 mol?L﹣1?s﹣1
B.59 s时,c(NO2)一定大于0.12 mol?L﹣1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K> ![]()
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol