题目内容
(1)1mol不同固体物质的体积各不相同,其原因是:① ,在同温同压时任何气体间一定几乎相同的是② .(2)在下列反应方程式中标明电子转移的方向和数目(单线桥)(该反应中H2O2只发生如下变化过程:H2O2→O2)③
2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O 此反应中若生成标准状况下氧气6.72L,则转移电子的物质的量为④
(3)在物质分类中硫酸氢钠除属于钠盐、可溶性盐、硫酸氢盐外还可划分为⑤ 盐.
(4)一定条件下NaHSO4与Ba(OH)2反应的离子反应可写为:
H++SO42-+Ba2++OH-=BaSO4↓+H2O,则所得溶液呈⑥ 性(酸性或碱性),若要所得溶液呈中性则继续反应的离子方程式为⑦
(5)氧化还原反应是由氧化反应和还原反应组成的对立统一体如:
3Cu+8HNO3=3Cu(NO)3+2NO↑+4H2O 氧化:3Cu-6e-=3Cu2+;还原:2NO3-+6e-+8H+=2NO↑+4H2O试写出铝投入氢氧化钠溶液中发生反应的离子方程式⑧ ,可拆分成氧化和还原过程:氧化:2Al-6e-+8OH-=2AlO2-+4H2O,试写出 还原:⑨ .
【答案】分析:(1)相同条件下决定固体物质的主要因素为微粒的大小,相同条件下气体物质的分子间距相同;
(2)Cr元素由+6价降低为+3价,该反应中生成3molO2转移的电子为6e-;
(3)根据硫酸氢钠的组成和性质来分析;
(4)由离子反应可知,碱剩余,使溶液为中性时继续发生酸碱中和反应;
(5)在保证电子守恒的条件下,利用总的离子反应减去氧化反应即可得到还原反应.
解答:解:(1)相同条件下决定固体物质的主要因素为微粒的大小,则1mol不同固体物质的体积各不相同是因固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同,而同温同压时任何气体间一定几乎相同是因相同条件下气体物质的分子间平均距离相同,
故答案为:固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同;分子间的平均距离;
(2)Cr元素由+6价降低为+3价,该反应中生成3molO2转移的电子为6e-,电子转移的方向和数目(单线桥)为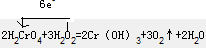 ,若生成标准状况下氧气6.72L,转移电子的物质的量为
,若生成标准状况下氧气6.72L,转移电子的物质的量为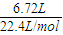 ×2=0.6mol,故答案为:
×2=0.6mol,故答案为: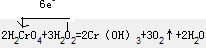 ;0.6mol;
;0.6mol;
(3)硫酸氢钠中含有硫酸根离子或硫酸氢根离子,则硫酸氢盐外还可划分为酸式或含氧酸盐,
故答案为:酸式或含氧酸;
(4)由H++SO42-+Ba2++OH-=BaSO4↓+H2O可知,碱剩余,则溶液显碱性,而使溶液为中性时继续发生酸碱中和反应,发生的离子反应为H++OH-=H2O,
故答案为:碱性;H++OH-=H2O;
(5)铝投入氢氧化钠溶液中发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中转移电子为6e-,氧化反应为2Al-6e-+8OH-=2AlO2-+4H2O,则在保证电子守恒的条件下,利用总的离子反应减去氧化反应得到还原反应为6H2O+6e-=3H2+6OH-,故答案为:6H2O+6e-=3H2+6OH-.
点评:本题考查知识点较多,为小综合,注重对物质的分类、离子反应、氧化还原反应等常考知识点的考查,题目难度不大,注重信息与所学知识的结合来解答.
(2)Cr元素由+6价降低为+3价,该反应中生成3molO2转移的电子为6e-;
(3)根据硫酸氢钠的组成和性质来分析;
(4)由离子反应可知,碱剩余,使溶液为中性时继续发生酸碱中和反应;
(5)在保证电子守恒的条件下,利用总的离子反应减去氧化反应即可得到还原反应.
解答:解:(1)相同条件下决定固体物质的主要因素为微粒的大小,则1mol不同固体物质的体积各不相同是因固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同,而同温同压时任何气体间一定几乎相同是因相同条件下气体物质的分子间平均距离相同,
故答案为:固体微粒间的平均距离相对微粒大小可忽略,而不同的固体微粒大小不同,所以1mol不同固体物质的体积各不相同;分子间的平均距离;
(2)Cr元素由+6价降低为+3价,该反应中生成3molO2转移的电子为6e-,电子转移的方向和数目(单线桥)为
 ,若生成标准状况下氧气6.72L,转移电子的物质的量为
,若生成标准状况下氧气6.72L,转移电子的物质的量为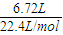 ×2=0.6mol,故答案为:
×2=0.6mol,故答案为: ;0.6mol;
;0.6mol;(3)硫酸氢钠中含有硫酸根离子或硫酸氢根离子,则硫酸氢盐外还可划分为酸式或含氧酸盐,
故答案为:酸式或含氧酸;
(4)由H++SO42-+Ba2++OH-=BaSO4↓+H2O可知,碱剩余,则溶液显碱性,而使溶液为中性时继续发生酸碱中和反应,发生的离子反应为H++OH-=H2O,
故答案为:碱性;H++OH-=H2O;
(5)铝投入氢氧化钠溶液中发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,该反应中转移电子为6e-,氧化反应为2Al-6e-+8OH-=2AlO2-+4H2O,则在保证电子守恒的条件下,利用总的离子反应减去氧化反应得到还原反应为6H2O+6e-=3H2+6OH-,故答案为:6H2O+6e-=3H2+6OH-.
点评:本题考查知识点较多,为小综合,注重对物质的分类、离子反应、氧化还原反应等常考知识点的考查,题目难度不大,注重信息与所学知识的结合来解答.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
