题目内容
1.对10mL 1mol/L的盐酸与一小块大理石的化学反应:CaCO3+2HCl═CaCl2+CO2↑+H2O,下列措施对化学反应速率几乎无影响的是( )| A. | 加入一定量的CaCl2固体 | B. | 通入一定量的HCl气体 | ||
| C. | 加入10 mL0.5 mol/L的盐酸 | D. | 加入5 mL H2O |
分析 根据影响反应速率的一些常见因素:反应物的浓度、浓度、压强、催化剂、反应物的接触面等来分析.
解答 解:A.加入一定量的CaCl2固体,氢离子的浓度不变,化学反应速率不变,故A正确;
B.通入一定量的HCl气体,氢离子的浓度增大,化学反应速率加快,故B错误;
C.加入10mL0.5mol/L的盐酸,减小了反应物的浓度,化学反应速率减小,故C错误;
D.加入5mLH2O,减小了反应物的浓度,化学反应速率减小,故D错误.
故选A.
点评 本题考查反应速率的影响因素,注意把握影响反应速率的因素,难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
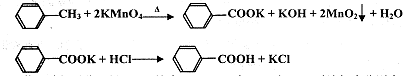
11.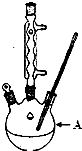 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
请回答:
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g.
实验流程:
①往装置A中加入2.7mL(2.3g)甲苯和125mL水,然后分批次加入8.5g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热.
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品.
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如表所示.
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称三颈烧瓶.若不用温度计,本实验控制反应温度的措施为沸水浴加热.
(2)白色粗产品中除了KCl外,其他可能的无机杂质为MnCl2.
(3)操作②中趁热过滤的目的是防止苯甲酸结晶析出,减少其损失,操作I的名称过滤、干燥.
(4)步骤③中用到的定量仪器有分析天平,100mL容量瓶,50mL酸式、碱式滴定管.
(5)样品中苯甲酸纯度为96.00%.
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将偏小(填“偏大”、“偏小”或“不变”).
9.下列说法正确的是( )
| A. | 自发进行的化学反应不一定是放热反应 | |
| B. | 自发过程将导致体系的熵增大 | |
| C. | △H-T△S<0的反应,不需要任何条件就可自发进行 | |
| D. | 同一物质的气、液、固三种状态的熵值依次增大 |
16.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 17g NH4+中含有的质子数为11NA | |
| C. | 46 g NO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
6.一种化学冰袋中含有Na2SO4•10H2O和NH4NO3,将它们混合并用手搓揉就可制冷,且制冷效果能维持一段时间.以下关于其制冷原因的推测,肯定错误的是( )
| A. | Na2SO4•10H2O脱水是吸热过程 | |
| B. | 较长时间制冷是由于Na2SO4•10H2O脱水是较慢的过程 | |
| C. | 铵盐在该条件下,发生的复分解反应是吸热反应 | |
| D. | NH4NO3溶于水会吸收热量 |
13.下列各种试纸,使用时预先不能用蒸馏水湿润的是( )
| A. | 红色石蕊试纸 | B. | 淀粉KI试纸 | C. | pH试纸 | D. | 蓝色石蕊试纸 |
10.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟甲基(-CH2OH)和甲氧基(-OCH3) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2-) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟基(-OH)和氢氧根(OH-) |
11.常温下,有关100ml 0.1mol/L的醋酸溶液的以下说法正确的是( )
| A. | 由水电离出来的c(H+)=1.0×10-13mol/L | |
| B. | 该溶液中只含CH3COOH、H+、CH3COO-、OH-4种微粒 | |
| C. | 加水稀释10倍后,不是所有离子的浓度都减小 | |
| D. | 与同体积、同浓度盐酸溶液所含溶质的物质的量相等 |