题目内容
(1)五种元素的原子电子层结构如下:A:1s22s22p63s23p63d54s2、B:1s22s22p63s2、C:1s22s22p6、D:1s22s22p63s23p2、E:1s22s1.请回答:(填元素符号)
________元素的电负性最大,________元素原子的第一电离能最大,________元素最可能生成具有催化性质的氧化物.
(2)钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”,钛有4822Ti和5022Ti两种原子,它们互称为________.Ti元素在元素周期表中的位置是第________,按电子排布Ti元素在元素周期表分区中属于________区元素.
(3)A、B两种元素的电离能数据如下(kJ·mol-1):
化合价是元素的一种性质.由A、B的电离能数据判断,A通常显________价,B显________价.
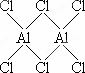
(4)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中你认为是配位键的斜线上加上箭头.
(5)假设原子晶体SiO2中Si原子被铝原子取代,不足的价数由钾原子补充.当有25%的硅原子被铝原子取代时,可形成正长石.则正长石的化学组成为________.
(6)NH3极易溶于水其原因是________.
答案:

练习册系列答案
相关题目
 ;由R生成Q的化学方程式: 。
;由R生成Q的化学方程式: 。