题目内容
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是( )
| A.此法的优点之一是原料来源丰富 | B.①②③步骤的目的是从海水中提取MgCl2 |
| C.提取镁的过程中没有氧化还原反应 | D.第④步电解时同时产生氯气 |
C
解析试题分析:CaCO3 CaO+CO2,CaO+H2O=Ca(OH)2, Ca(OH)2+MgCl2= CaCl2+Mg(OH)2↓, Mg(OH)2+2HCl= 2H2O +MgCl2, MgCl2
CaO+CO2,CaO+H2O=Ca(OH)2, Ca(OH)2+MgCl2= CaCl2+Mg(OH)2↓, Mg(OH)2+2HCl= 2H2O +MgCl2, MgCl2 Mg+Cl2↑. A.此法的优点之一是原料贝壳、海水来源丰富。正确。由方程式可看出前三步目的就是为了从海水中获得制取Mg的原料---纯净的MgCl2。正确。C.电解熔融的MgCl2制取Mg的反应是氧化还原反应。错误。D.由方程式MgCl2
Mg+Cl2↑. A.此法的优点之一是原料贝壳、海水来源丰富。正确。由方程式可看出前三步目的就是为了从海水中获得制取Mg的原料---纯净的MgCl2。正确。C.电解熔融的MgCl2制取Mg的反应是氧化还原反应。错误。D.由方程式MgCl2 Mg+Cl2↑可看出在电解产生Mg的同时也产生了氯气。正确。
Mg+Cl2↑可看出在电解产生Mg的同时也产生了氯气。正确。
考点:考查以贝壳、海水为原料制备Mg的化学反应原理的知识。

下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是
| 选项 | 物质 | 使用的试剂 | 主要操作 |
| A | 乙醇(水) | 金属钠 | 过滤 |
| B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
| D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
矿盐的主要成分是NaCl,还混有SO42-等其他可溶性杂质的离子。下列有关说法正确的是
| A.用矿盐生产食盐,除去SO42-最合适的试剂是Ba(NO3)2 |
| B.工业上通过电解氯化钠溶液制备金属钠和氯气 |
| C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度 |
| D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液 |
下列除杂的方法错误的是
| A.除去N2中的少量O2:通过灼热的Cu粉,收集气体 |
| B.除去SO2中的少量HCl:通入饱和NaHSO3溶液,干燥后收集气体 |
| C.除去Fe2O3固体中少量Al2O3:加入足量NaOH溶液,过滤、洗涤、干燥 |
| D.除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 |
如图各装置不能达到实验目的的是( )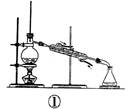
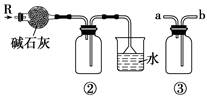
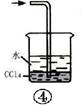
| A.装置①可用于由工业酒精制取无水酒精 | B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集NO气体 | D.装置④中下层物质若为四氯化碳,则可用于吸收氯化氢 |
离子检验的常用方法有三种:
| 检验方法 | 沉淀法 | 显色法 | 气体法 |
| 含义 | 反应中有沉淀产生或溶解 | 反应中有颜色变化 | 反应中有气体产生 |
A.NH4+-气体法 B.I--沉淀法
C.Fe3+-显色法 D.Ca2+-气体法
下列各组物质的溶液,不用其它试剂通过互滴即可鉴别的是( )
①NaOH、MgCl2、AlCl3、K2SO4
②CuSO4、Na2CO3、Ba(OH)2、H2SO4
③HNO3、NaAlO2或Na[Al(OH)4]、NaHSO4、NaCl
④NaOH、(NH4)2CO3、BaCl2、MgSO4
| A.①② | B.①③ | C.①②④ | D.①③④ |
如图,在盛有碘水的三支试管中分别加入苯(密度比水小,不溶于水)、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论有( )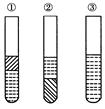
| A.①加入的是CCl4,②是苯,③加酒精 |
| B.①加入的是酒精,②加CCl4,③加苯 |
| C.①加入的是苯,②加CCl4,③加酒精 |
| D.①加入的是苯,②加酒精,③加CCl4 |
下列除去杂质的方法正确的是
| A.除去CO2中混有的CO:用澄清石灰水洗气 |
| B.除去BaCO3固体中混有的BaSO4:加过量盐酸后,过滤、洗涤 |
| C.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D.除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |