题目内容
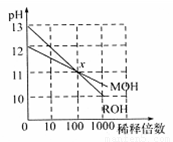
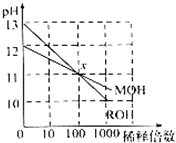
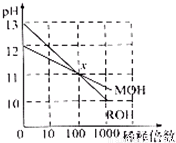
 常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )分析:由图可知,ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,而MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,并根据酸碱中和及电离来解答.
解答:解:A.ROH开始的pH=13,稀释100倍pH=11,则ROH为强碱,MOH开始的pH=12,稀释100倍pH=11,则MOH为弱碱,故A正确;
B.MOH为弱碱,等物质的量浓度的MOH与盐酸反应,假设等体积的两种物质反应,则所得溶液呈酸性,要使所得溶液呈中性,则碱应该稍微过量,所以碱的体积应该大于酸,故B正确;
C.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故C正确;
D.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故选D.
B.MOH为弱碱,等物质的量浓度的MOH与盐酸反应,假设等体积的两种物质反应,则所得溶液呈酸性,要使所得溶液呈中性,则碱应该稍微过量,所以碱的体积应该大于酸,故B正确;
C.由ROH═R++OH-,MOH?M++OH-可知,在x点,c(OH-)相等,则c(M+)=c(R+),故C正确;
D.稀释前,c(ROH)=0.1mol/L,c(MOH)>0.01mol/L,则c(ROH)<10c(MOH),故D错误;
故选D.
点评:本题考查电解质在水中的电离及图象,明确图象中pH的变化及交点的意义是解答本题的关键,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
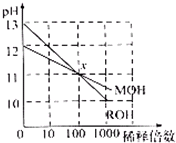 (2014?滨州一模)常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )
(2014?滨州一模)常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是( )