题目内容
第题(分)人造金刚石酸洗废液中含有大量的Ni2+、Mn2+、Co2+离子,不经处理排放危害极大。某工厂技术人员设计了创新方案,使有害离子的浓度降低到排放标准,同时得到了纯度较高的镍粉。
废液经分析组成如下:
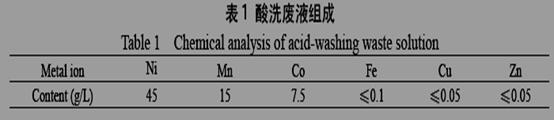
在强酸性的废液中加入NaOH调节pH到2,在搅拌下加入饱和Na2CO3溶液和NaClO除去Mn2+、Co2+,并控制pH不超过3.5(Na2CO3需缓慢加入,防止产生大量CO2而冒槽),过滤后电解含Ni2+的过滤液,以镍铬钛不锈钢片为阴极,以铅片为阳极,电解后在阴极得到镍粉。回答下列问题
⑴ 调节强酸性废液至pH=2,可否直接用饱和Na2CO3溶液?分析你的原因
⑵ 写出除去废液中Mn2+、Co2+的反应方程式
⑶ 搅拌过程中Ni不被沉淀下来,实际操作中是如何实现?
⑷ 电解过程中电流效率与pH的关系如下图,试分析如下图所示变化的原因.并选择电解的最佳pH值

⑴ 不可以,将产生大量CO2而冒槽 (1分)
⑵ ![]()
![]() (2分)
(2分)
⑶ 根据废液离子浓度分析结果,控制NaClO用量,可使Mn2+,Co2+沉淀完而Ni2+不被沉淀。(1分)
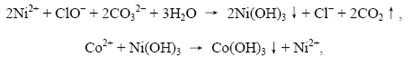
⑷ pH较低时,将产生大量氢气,电流效率低;pH>4.5时,将产生Ni(OH)2沉淀,Ni2+浓度下降,不利于Ni的析出。(2分)选择在4.0-4.5左右 (1分)
解析:
⑴认真阅读试题可从题中获得相关信息,当溶液酸性太强时,直接加入饱和Na2CO3溶液会产生大量的CO2,从而发生冒槽。
⑵Mn2+、Co2+在碱性增强的条件下,被ClO-氧化并生成沉淀,通过过滤的方法可以除去这两种杂质离子——这是溶液中除杂最常用的方法之一,如Fe2+的除杂。
Mn2+在碱性条件下,被氧化为+4,以MnO2的形式被除去,离子方程式为:
![]()
Co2+在碱性条件下不稳定,生成Co(Ⅲ)的氢氧化物,离子方程式如下:
![]()
在书写离子方程式的时候,也应该结合题意,溶液由于pH<3.5,仍为酸性条件,所以CO32-结合H+,生成CO2气体。
⑶Ni(Ⅲ)和Co(Ⅲ)都有很强的氧化性,但Ni(Ⅲ)非常不稳定,氧化性比Co(Ⅲ)化合物的氧化性强,因此只要ClO-适量,即使Ni2+被氧化生成了三价镍的化合物,也会被未参加反应的Co2+、Mn2+还原为Ni2+。因此防止Ni2+被沉淀的方法就是控制ClO-的用量。
⑷从图中曲线变化趋势可以看出,当溶液酸性较大时,电解效率很低,随着pH的增大,电解效率增大,但是当pH>4.5后,电解率与溶液pH变化不明显。因此此处要重点分析pH较小时电解效率不高,以及pH较大时电解效率也不高的原因。
由于H+、Ni2+都能在电极的阴极放电,所以当pH较小,也即[H+]较大时,将产生大量的氢气,造成电解效率较低。当pH较大时,由于Ni2+生成了难溶物,溶液中[Ni2+]减小,也造成电解效率低。因此,从图中可以看出来,最佳的pH范围大约为4.0~4.5。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案