题目内容
某同学用托盘天平称量镁粉25.2g(1g以下用游码),他把镁粉放在右盘,当天平平衡时,所称取的镁粉的实际质量是
| A.25.2g | B.25.8g | C.24.2g | D.24.8g |
D
由于在天平中,右盘的质量和游码的质量之和就是左盘的质量,所以,如果把镁粉放在右盘,则镁的实际质量是25.0g-0.2g=24.8g,答案选D。

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目




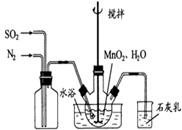
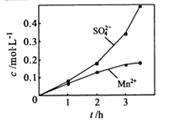
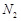 换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。
换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图。导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 。