题目内容
在H+、Mg2+、Fe2+、Fe3+、S2-、I-、S 中,只有氧化性的是
H+、Mg2+、Fe3+
H+、Mg2+、Fe3+
,只有还原性的是S2-、I-
S2-、I-
,既有氧化性又有还原性的是Fe2+、S
Fe2+、S
.分析:最高价态的元素只有氧化性,最低价态的元素只有还原性,中间价态的元素既有氧化性又有还原性,据此分析解答.
解答:解:氢离子、镁离子、铁离子中的化合价都是最高价态,所以都只有氧化性;
硫离子、碘离子中的化合价都是最低价态,所以都只有还原性;
亚铁离子和硫原子中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:H+、Mg2+、Fe3+;S2-、I-;Fe2+、S.
硫离子、碘离子中的化合价都是最低价态,所以都只有还原性;
亚铁离子和硫原子中的化合价是中间价态,所以既有氧化性又有还原性,
故答案为:H+、Mg2+、Fe3+;S2-、I-;Fe2+、S.
点评:本题考查了氧化性、还原性的判断,明确元素化合价与氧化性和还原性的关系是解本题关键,难度不大.

练习册系列答案
相关题目


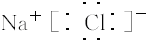
 (2011?海南)镁化合物具有广泛用途,请回答有关镁的下列问题:
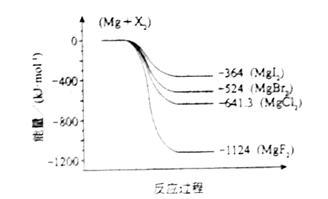
(2011?海南)镁化合物具有广泛用途,请回答有关镁的下列问题: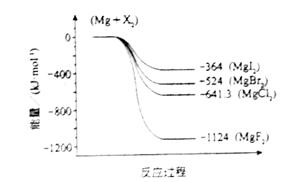
 HCO3- + H+ Ka1(H2CO3) = 4.45×10-7
HCO3- + H+ Ka1(H2CO3) = 4.45×10-7 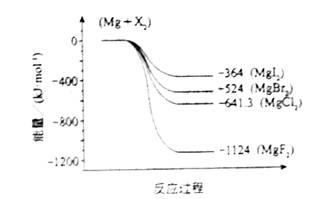
 HCO3- + H+
Ka1(H2CO3) = 4.45×10-7
HCO3- + H+
Ka1(H2CO3) = 4.45×10-7