题目内容
【题目】在溶液中,反应A+2B![]() C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
C分别在三种不同实验条件下进行,它们的起始状态均为c(A) = 0.100 mol·L-1 c(B) = 0.200 mol·L-1 、c(C) = 0 mol·L-1 。在三种条件下,反应物A的浓度随时间的变化如图所示。下列说法中正确的是
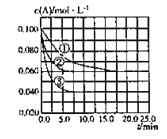
A. 反应的平衡常数:①<② B. 反应A+2B![]() C的△H >0
C的△H >0
C. 实验②平衡时B的转化率为60% D. 实验③平衡时c(C) = 0.04 mol·L-1
【答案】B
【解析】A.对比实验①和②,达到平衡时反应物A的浓度相同,故平衡常数相同,故A错误;B.反应速率增大,可能是升高温度或增大压强,但如是增大压强,对溶解的体积没有影响,平衡不应移动,现平衡向正反应方向移动,但A的平衡浓度反而增大,不符合图象,则应为升高温度,因③温度升高,化学平衡向吸热的方向移动,平衡时A的浓度减小,说明正反应方向吸热,故B正确;
C.根据A + 2B C
初始 (mol/L)0.10.20
转化 (mol/L) 0.04 0.080.04
平衡(mol/L) 0.06 0.12 0.04
所以平衡时B的转化率为![]() =0.4,故C错误;
=0.4,故C错误;
D.根据A + 2B C
初始 (mol/L)0.1 0.20
转化 (mol/L) 0.060.120.06
平衡(mol/L) 0.040.08 0.06
所以平衡时C的浓度为0.06mol/L,故D错误;故答案为B。

练习册系列答案
相关题目
【题目】下列除去括号内杂质所用的试剂和方法都正确的是
选项 | 物质 | 所用试剂 | 方法 |
A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
B | 乙醇(水) | 生石灰 | 分液 |
C | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
D | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
A. A B. B C. C D. D