题目内容
(16分)硼酸在玻璃制造和医药领域应用广泛。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式: 。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l) [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式 。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
下列说法正确的是 。
(1)元素周期表中存在“对角线”规则,硼与硅的某些化学性质类似,写出硼酸(H3BO3)加热至300℃时分解得到相应氧化物的化学方程式: 。
(2)硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)
 [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)①实验中不慎将NaOH沾到皮肤时,用大量水洗后要涂上硼酸溶液。写出硼酸与NaOH反应的离子方程式 。
②计算25℃时0.7mol·L–1硼酸溶液中H+的浓度。(写出计算过程,计算结果保留小数后一位)
(3)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10—7 K2=4.7×10—11 | K=1.75×10—5 |
| A.碳酸钠溶液滴入硼酸中能观察到有气泡产生 |
| B.碳酸钠溶液滴入醋酸中能观察到有气泡产生 |
| C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 |
| D.等物质的量浓度的碳酸氢钠溶液和醋酸钠溶液比较,pH:前者>后者 |
(16分)
(1)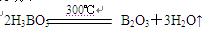 (2分)
(2分)
(2)①H3BO3+OH–= [B(OH)4] – (2分)
② (8分) H3BO3 (aq)+H2O (l) [B(OH)4] –(aq)+H+(aq)
[B(OH)4] –(aq)+H+(aq)
起始时各物质浓度/ mol·L—1: 0.70 0 0
平衡时各物质浓度/ mol·L—1: 0.70-x x x
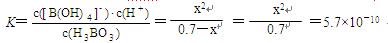
x2=3.99×10–10 x=2.0×10–5(mol·L—1)
(3)BD(4分)
(1)
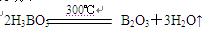 (2分)
(2分)(2)①H3BO3+OH–= [B(OH)4] – (2分)
② (8分) H3BO3 (aq)+H2O (l)
 [B(OH)4] –(aq)+H+(aq)
[B(OH)4] –(aq)+H+(aq)起始时各物质浓度/ mol·L—1: 0.70 0 0
平衡时各物质浓度/ mol·L—1: 0.70-x x x
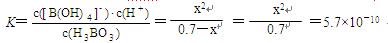
x2=3.99×10–10 x=2.0×10–5(mol·L—1)
(3)BD(4分)
略

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
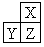
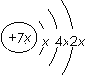 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为  。下列比较中正确的是( )
。下列比较中正确的是( ) 和
和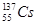 引起全世界的关注,其中
引起全世界的关注,其中