题目内容
I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式 。
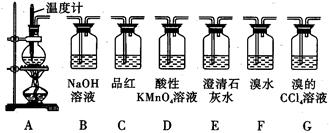
(2)查资料得知,HCOOH CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。

①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是 。
②装置(III)的主要作用是 。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充 装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净 。
(2)步骤d中加入硫酸,使其pH=2的目的是 ;要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
I.(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2)
(2)A、Cl2(答案合理即可)(共1分,共2分) (3)①防止CO与空气混合加热爆炸(2)
②检验CO是否转化为CO2(2) ③尾气处理装置(2)
Ⅱ.(1)取最后一次洗涤液少量,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净(合理即给分)(2分)
(2)抑制Zn2+水解 (1分);将溶液加热浓缩,冷却结晶 (2分);
蒸发皿,酒精灯,玻璃棒(3分)
解析试题分析:I.(1)硝酸具有强氧化性,能氧化单质铜,同时还有NO和水生成,所以用铜屑和稀硝酸为原料制取硝酸铜的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(2)该反应为液体加热制气装置,需要分液漏斗和酒精灯。因此选择装置A。根据装置特点可知,该装置还可以用用浓盐酸和二氧化锰加热可制取氯气。
(3)①CO是可燃性气体,加热时易发生爆炸,所以实验前,关闭旋塞K,先通氮气排净装置中的空气的目的是防止可燃性气体与空气或氧气混合加热发生爆炸。
②CO2遇澄清的石灰水变浑浊,而一氧化碳不能,所以装置(III)中澄清石灰水的主要作用是检验CO是否转化为CO2。
③一氧化碳有毒,所以要注意防止一氧化碳泄漏从而污染环境,所以还应在装置(Ⅳ)后补充尾气处理装置。
II.(1)由于沉淀表面有吸附的氯离子,所以检验沉淀是否洗净的实验操作是:取最后一次洗涤液少量,滴加硝酸银溶液,若无白色沉淀,说明已经洗涤干净。
(2)因为Zn2+完全沉淀时的pH为6.4~8.0,所以步骤d中加入硫酸,使其pH=2的目的是抑制Zn2+水解;要制得ZnSO4?7H2O还需要将溶液加热浓缩,冷却结晶;加热蒸发需要使用硅酸盐仪器是蒸发皿,酒精灯,玻璃棒。
考点:考查常见生活环境的污染及治理;难溶电解质的溶解平衡及沉淀转化的本质;氮的氧化物的性质及其对环境的影响;化学实验基本操作等

 优生乐园系列答案
优生乐园系列答案工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
(2)在“除杂I”步骤中,需再加入适量H2O2溶液,目的是将Fe2+氧化为 ,便于调节溶液的pH使铁元素转化为氢氧化物沉淀除去。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 ~ 。检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加 溶液,若不出现血红色,表明Fe3+沉淀完全。
(3)加入Zn粉的作用是除去溶液中的 。
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)乙中反应的离子方程式为 。
(2)乙中生成的气体除N2和CO2外,还有副产物HCl及Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。则丙中加入的除杂试剂是___________(填字母)
| A.饱和食盐水 | B.饱和NaHCO3溶液 | C.浓NaOH溶液 | D.浓硫酸 |
装有碱石灰的干燥管的作用是 。
(4)戊中盛有含Ca(OH)2 0.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。若该测得值与实际处理的百分率相比偏低,请简要说明可能的任意一个原因 。
(5)请提出一个能提高准确度的建议(要有可操作性,不宜使操作变得过于复杂) 。
CuSO4溶液与Na2CO3溶液混合产生蓝绿色沉淀,以下是某兴趣小组对沉淀组成的探究。
【提出假设】
假设1:沉淀为Cu (OH)2
假设2:沉淀为
假设3:沉淀为碱式碳酸铜[化学式可表示为nCuCO3·mCu (OH)2]
【查阅资料】无论是哪一种沉淀受热均易分解(假设均不含结晶水)。
【定性探究】
步骤1:将所得悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤,风干;
步骤2:甲同学取一定量固体,用气密性良好的如下装置(夹持仪器未画出)进行定性实验;
(1)若反应后A中蓝绿色固体变黑,C中无明显现象,证明假设 成立。
(2)乙同学认为只要将上图中B装置的试剂改用下列某试剂后,便可验证上述所有假设,该试剂是 (填代号)。
a.浓硫酸 b.无水CuSO4 c.碱石灰 d.P2O5
(3)乙同学更换B试剂后验证假设3成立的实验现象是 。
【定量探究】
(4)乙同学进一步探究假设3中固体的组成:
①乙同学查得一些物质在20℃的数据(如下表)后,将C中的澄清石灰水改为Ba(OH)2溶液,其原因是 (双选,填代号)
| 溶解度(S)/g | 溶度积(Ksp) | 摩尔质量(M)/g·mol-1 | |||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 | 100 | 197 |
b.Ba(OH)2为强碱,Ca(OH)2为弱碱
c.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
d.相同条件下,CaCO3的溶解度明显大于BaCO3
②若所取蓝绿色固体质量为54.2 g,实验结束后装置B的质量增加5.4 g,C中的产生沉淀的质量为39.4 g。则该蓝绿色固体的化学式为 。