题目内容
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)铜原子在基态时的价电子排布式为__________。金属铜的结构形式为面心立方最密堆积,晶胞中每个铜原子周围最近的铜原子有________个。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能大于硒。请从原子结构的角度 加以解释_______________________。
(3)GaC13和AsF3的空间构型分别是:_________,_______。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为____________;
②[B(OH)4]-的结构式为_________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是______________(用化学式表示);
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm (1pm=10-12m)。立方氮化硼的密度是______g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
【答案】(1)3d10(2分)(2)砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大。(2分)
(3)原子晶体109°28′(2分)
(4)平面三角形,三角锥(2分)
(5)①sp3(1分)②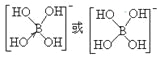 (2分)
(2分)
(6)①C>SiC>Si(2分)②![]() (2分)
(2分)
【解析】试题分析:(1)铜的核电荷数为29,根据构造原理排列为[Ar]3d104s1,Cu+为失去1个电子后达到全满的结构,故价电子排布为3d10;
(2)砷的4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,所以砷的第一电离能大于硒。
(3)GaAs熔点1238℃,难溶于溶剂,说明晶体类型为原子晶体,根据Ga、As原子结构推测,GaAs晶体与金刚石类似,其键角为109°28′。
(4)GaCl3和AsF3的中心原子价层电子对数分别是3、3+(5-1×3)/2=4,所以空间构型分别是平面三角形,三角锥。
(5)①[B(OH)4]-中B原子的价层电子对数是4,杂化类型为sp3。
②硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性,这说明[B(OH)4]-中含有配位键,则结构式为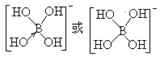 ;
;
(6)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小。熔点越高,即熔点高低顺序为C>SiC>Si。
②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。因此如果晶胞边长为361.5pm,则立方氮化硼的密度是![]() g·cm-3。
g·cm-3。

 阅读快车系列答案
阅读快车系列答案【题目】下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
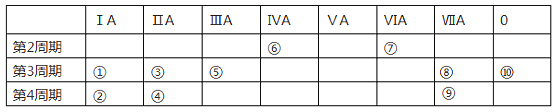
(1)10种元素中,化学性质最不活泼的是________________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___________。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是____________。
(4)元素⑦的氢化物常温下和元素⑧的单质反应的化学方程式为:____________。
(5)①和⑨两种元素形成化合物的化学式为_________,该化合物溶液与元素⑧的单质反应的化学方程式为_______________。
(6)已知元素的电负性与元素的化合价一样,也是J已索的一种基本性质。下面给出14种元素的电负性。
元素 | Al | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2 | 1.5 | 2.5 | 2.8 | 4 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
试结合元素周期律知识完成下列问题:
(1)根据上表给出的数据,推测元素的电负性的变化规律是:_________,_________。
(2)预测Br与I元素电负性的大小关系_________,前四周期中,电负性最小的元素是_________。