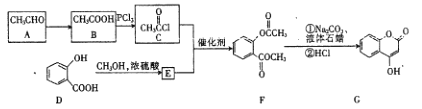
题目内容
【题目】某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,关于该元素的说法正确的是( )
A. 在自然界中既有化合态又有游离态
B. 单质常用作半导体材料
C. 气态氢化物很稳定
D. 最高价氧化物不与任何酸反应,可制光导纤维
【答案】B
【解析】试题分析:该元素为硅,A、硅在自然界中以化合态形式出现无游离态硅,故错误;B、硅是良好的半导体材料,故正确;C、由于硅的非金属性较弱,所以其气态氢化物很不稳定,故错误;D、硅的最高价氧化物为二氧化硅,可与氢氟酸反应,故错误。

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
【题目】根据下表中烃的分子式排列规律,判断空格中烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H4 | C4H10 | C5H10 | C6H10 | C7H16 |
A.C7H18 B. C7H14 C.C8H18 D.C8H16