题目内容
阅读下表中短周期主族元素的相关信息。
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
(1)E在元素周期表中的位置__________;C的简单离子的结构示意图_______。
(2)X的化学式为____________。
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序为___________(用离子符号表示)。
(4)A在真空压下能与由元素D、E组成的化合物ED4反应生成两种固体物质,其中一种是自然界中硬度最大的物质,此反应在科学上有“稻草变黄金”的美称。写出该反应的化学方程式______________________。
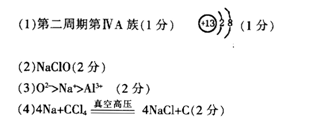
解析试题分析:A的单质能与冷水剧烈反应,得到强碱性溶液,在短周期中只有Na符合,只有O最外层6个电子,是内层电子数的3倍,在第3周期中,离子半径最小的是Al3+,根据A、B、D组成的36电子的化合物X是家用消毒剂的主要成分,可以推出X为NaClO,D为Cl,有机物都含有C,所以E为C。A、B、C三种元素形成的简单离子为Na+、O2?、Al3+,具有相同电子排布的离子,原子序数越大,离子半径越小,所以O2?>Na+>Al3+。ED4为CCl4,与钠反应,生成自然界中硬度最大的物质为金刚石,根据元素守恒可知另一固体产物为NaCl,配平可得化学方程式。
考点:本题考查原子结构、元素周期律和元素周期表的应用。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关原子结构或元素性质说法正确的是
| A.原子核外电子排布式为1s2的元素与原子核外电子排布式为1s22s2的元素化学性质相似 |
B.基态碳原子的价电子排布图: |
C.基态铜原子的价电子排布图: |
| D.Fe3+的最外层电子排布式为:3s23p63d5 |
下列大小关系比较正确的是
| A.离子半径:F-<Na+<Mg2+ |
| B.电负性:C<O<N |
| C.氢化物的沸点:NH3<PH3<AsH3 |
| D.碱性: NaOH>Mg(OH)2> Al(OH)3 |
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
下列元素中非金属性最强的是
| A.氯 | B.氧 | C.氟 | D.溴 |
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是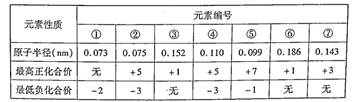
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
