题目内容
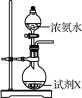
【题目】在25℃时,用一定浓度NaOH溶液滴定醋酸溶液,滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点;溶液总体积变化忽略不计)下列说法正确的是
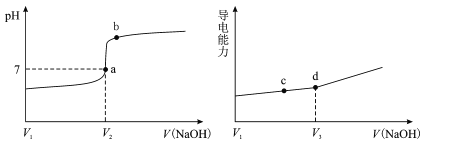
A.a→b过程中,水的电离程度不断增大
B.d点对应的溶液中:c(CH3COO-)+c(CH3COOH)=c(Na+)
C.c→d过程中,溶液导电性增强的主要原因是c(OH-)和c(Na+)增大
D.根据溶液pH和导电能力的变化可判断:V2>V3
【答案】B
【解析】
溶液pH值与氢离子浓度有关,NaOH和醋酸恰好完全反应时,溶质为醋酸钠,显碱性,即恰好完全反应的点在a点的右边且在pH突变范围内(b点左边),所以,V2时溶液为醋酸钠和醋酸的混合溶液;该滴定过程中,导电能力与离子总浓度有关,d点导电能力出现“拐点”,则V3时醋酸与NaOH恰好完全反应,溶质为醋酸钠,据此回答问题。
A.结合分析可知,a点时,溶质为醋酸钠和醋酸,恰好完全反应的点在a点和b点之间,假设为e点,则a点(醋酸钠和醋酸)到e点(醋酸钠),水的电离程度增大,e点(醋酸钠)到b点(醋酸钠和NaOH),水的电离程度减小,A错误;
B.d点溶质为CH3COONa,存在物料守恒:c(CH3COO-)+c(CH3COOH)=c(Na+),B正确;
C.d点溶质为CH3COONa,则c点(CH3COONa和CH3COOH)→d点(CH3COONa)溶液导电性增强的主要原因是c(CH3COO) 和c(Na+)增大,C错误;
D.结合分析可知,加入V2mLNaOH溶液时,pH=7 ,醋酸还没中和完,加入V3mLNaOH溶液时,醋酸恰好中和完,V2< V3,D错误;
答案选B。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目