题目内容
13.X、Y、Z、W是原子序数依次增大的短周期主族元素.X、W同主族,Z、W同周期,X原子核电荷数是Y原子核电荷数的$\frac{3}{4}$,W原子最外层电子数是Z原子最外层电子数的4倍,下列说法中正确的是( )| A. | 原子半径:X>Y>Z>W | |
| B. | 单质的熔沸点:W>Z | |
| C. | 最简单氢化物的稳定性:X>Y | |
| D. | X、Y、Z三种元素形成的化合物的摩尔质量一定为106g•mol-1 |
分析 X、Y、Z、W是原子序数依次增大的短周期主族元素,W原子最外层电子数是Z原子最外层电子数的4倍,W属于主族元素,最外层电子数不能超过8个,则W最外层电子数是4、Z原子最外层电子数是1,所以W位于第IVA族、Z位于第IA族,X、W同主族,则X位于第IVA族,X原子序数小于W,且都是短周期元素,所以X是C元素、W是Si元素,Z、W同周期,则Z是第三周期元素,W位于第IA族,则Z为Na元素;X原子核内质子数是Y原子核内质子数的$\frac{3}{4}$,X原子核内6个质子,则Y核内8个质子,故Y为O元素.
解答 解:X、Y、Z、W是原子序数依次增大的短周期主族元素,W原子最外层电子数是Z原子最外层电子数的4倍,W属于主族元素,最外层电子数不能超过8个,则W最外层电子数是4、Z原子最外层电子数是1,所以W位于第IVA族、Z位于第IA族,X、W同主族,则X位于第IVA族,X原子序数小于W,且都是短周期元素,所以X是C元素、W是Si元素,Z、W同周期,则Z是第三周期元素,W位于第IA族,则Z为Na元素;X原子核内质子数是Y原子核内质子数的$\frac{3}{4}$,X原子核内6个质子,则Y核内8个质子,故Y为O元素.
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故r(Na)>r(Si)>r(C)>r(O),故A错误;
B.Si单质为原子晶体,熔沸点很高,Na单质为金属晶体且熔沸点比较低,故B正确;
C.非金属性X(C)<Y(O),最简单氢化物的稳定性:X<Y,故C错误;
D.X、Y、Z三种元素可以形成化合物Na2CO3、Na2C2O4,Na2C2O4摩尔质量为134g•mol-1,故D错误;
故选B.
点评 本题考查位置结构性质的相互关系及应用,涉及元素判断、元素周期律、晶体类型等知识点,D选项为易错点,学生容易忽略醋酸钠,题目难度中等.

| A. | $\frac{11.2bc}{a{N}_{A}}$ L | B. | $\frac{11.2ab}{c{N}_{A}}$L | C. | $\frac{11.2ac}{b{N}_{A}}$ L | D. | $\frac{11.2b}{ac{N}_{A}}$L |
| A. | 铜片 | B. | 硫酸溶液 | C. | 熔融的氯化钠 | D. | 固体氯化钾 |
| A. | 二氧化锰和HSCN溶液加热反应:MnO2+4HSCN$\frac{\underline{\;\;△\;\;}}{\;}$Mn(SCN)2+(SCN)2↑+2H2O | |
| B. | (CN)2和氢氧化钾溶液反应:(CN)2+2KOH═KCN+KCNO+H2O | |
| C. | 碘晶体投入HCN溶液中:I2+2HCN═2HI+(CN)2 | |
| D. | (SCN)2和水反应:(SCN)2+H2O?HSCN+HSCNO |

| A. | 溶液中c(A2+)减小 | |
| B. | B的电极反应:B-2e-=B2+ | |
| C. | y电极上有H2产生,发生还原反应 | |
| D. | 反应初期,x电极周围出现白色胶状沉淀,一段时间以后沉淀逐渐溶解 |
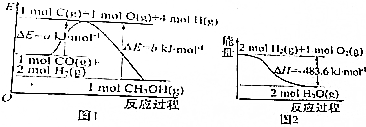
| A. | 1mol Na0H分别和1mol CH3COOH、1mol HN03反应,后者比前者△H小 | |
| B. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH30H(g),△H1=(b-a)kJ•mol-1 | |
| C. | 图2表示2molH2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
| A. | 碳原子的sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| B. | 碳原子的sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| C. | 碳原子的sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 | |
| D. | 碳、氧之间是sp2形成的σ键,碳、氧之间是未参加杂化的2p轨道形成的π键 | |
| E. | 碳、氧之间是sp2形成的σ键,碳、氢之间是未参加杂化的2p轨道形成的π键 |