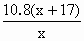题目内容
今有某碱金属R及其氧化物R2O的混合物共10.8g,往其中加足量的水,充分反应后,溶液经蒸发、干燥,得16g固体.试经过计算,确定是哪一种碱金属.
答案:钠
解析:
提示:
解析:
|
设R的相对原子质量为x,当混合物全是碱金属时和全是碱金属氧化物时,分别有: 2R+2H2O=2ROH+H2↑ 2x 2(x+17) 10.8g R2O+H2O=2ROH 2x+16 2(x+17) 10.8g 根据题意,该混合物是碱金属和它的氧化物,则可建立不等式:
解之得10.7<x<35.3, 所以从碱金属的相对原子质量可知该碱金属为钠. |
提示:
|
此题若用常规方法求解则无法解答,若用极值思维方法进行求解就能快速解答.在化学计算中若能进行该类思维的运用,可以收到事半功倍的效果. |

练习册系列答案
相关题目

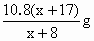
 <16<
<16<