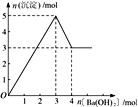
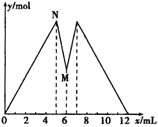
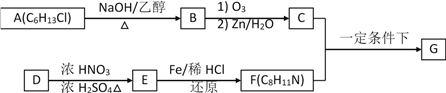题目内容
【题目】下列有关装置图的叙述中正确的是
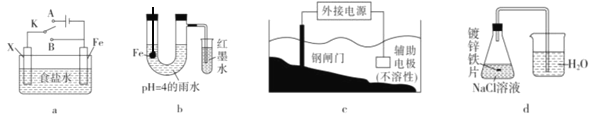
A. 图a中,如果X为锌电极,开关K放到A处或放到B处都能使铁电极受到保护
B. 图b小试管中的导管开始一段时间内液面上升
C. 为保护钢闸门,图c中的钢闸门应与外接电源的正极相连
D. 图d的右侧烧杯中,导管口有气泡冒出
【答案】A
【解析】A项,图a中,如果X为锌电极,若开关K放到A处,是外接电流的阴极保护法,若开关K放到B处,是牺牲阳极的阴极保护法,都能使铁电极受到保护,故A正确;B项,图b中,铁在酸性条件下发生析氢腐蚀,U形管内压强增大,小试管中的导管开始一段时间内液面下降,故B错误;C项,若钢闸门与正极相连,则铁为阳极,失去电子发生氧化反应,会加快金属腐蚀,所以图c中为保护钢闸门,应与外接电源的负极相连,故C错误;D项,图d中电解质溶液为中性,金属发生吸氧腐蚀,锥形瓶中压强减小,右侧烧杯中,导管口不会有气泡冒出,故D错误。

练习册系列答案
相关题目