题目内容
“铝热反应”的化学方程式为:2Al+Fe2O3
Al2O3+2Fe.某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3的熔点、沸点数据分别如下:
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金.这种推测有一定的道理,理由是:
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
(3)实验室溶解该熔融物,最好选用下列试剂中的
a.浓硫酸 b.稀硫酸 c.稀硝酸 d.氢氧化钠溶液.
| ||
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起
该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是
氢氧化钠溶液
氢氧化钠溶液
,当观察到有气泡产生
有气泡产生
现象时,说明熔融物中含有金属铝.(3)实验室溶解该熔融物,最好选用下列试剂中的
b
b
(选填字母序号).a.浓硫酸 b.稀硫酸 c.稀硝酸 d.氢氧化钠溶液.
分析:(1)当金属铁呈液态时,由于金属铝的熔点比铁低,所以金属铝也是液态;
(2)金属铝能和氢氧化钠反应放出氢气,而金属铁和氢氧化钠不反应;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染.
(2)金属铝能和氢氧化钠反应放出氢气,而金属铁和氢氧化钠不反应;
(3)既能和金属铁反应又能和金属铝反应的物质是稀硫酸,并且获得的产物无污染.
解答:解:(1)根据表中的数据可以看出,金属铝的熔点点比铁低,当金属铁是液态时,金属铝也是液态,所以铝热反应得到的是金属铁和金属铝的混合物;
故答案为:该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起;
(2)金属铝能和氢氧化钠反应放出氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑;而金属铁和氢氧化钠不反应,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝;
故答案为:氢氧化钠溶液;有气泡产生;
(3)既能和金属铁反应又能和金属铝反应的物质是b稀硫酸,并且获得的产物无污染;浓硫酸在常温下可以和金属铝钝化,稀硝酸可以和金属反应产生有毒的一氧化氮气体,氢氧化钠只和金属铝反应而不与金属铁不反应;
故选b.
故答案为:该反应温度下铝已熔化,未反应的铝与生成的铁熔合在一起;
(2)金属铝能和氢氧化钠反应放出氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑;而金属铁和氢氧化钠不反应,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝;
故答案为:氢氧化钠溶液;有气泡产生;
(3)既能和金属铁反应又能和金属铝反应的物质是b稀硫酸,并且获得的产物无污染;浓硫酸在常温下可以和金属铝钝化,稀硝酸可以和金属反应产生有毒的一氧化氮气体,氢氧化钠只和金属铝反应而不与金属铁不反应;
故选b.
点评:本题考查学生金属铝的化学性质,可以根据所学知识完成,难度中等.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
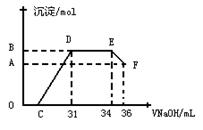
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为: 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为 。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为 。
(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
Ⅱ. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
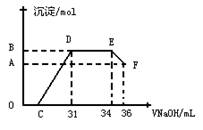
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为: 。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为 。
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为 。
 (1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时,放出222.5kJ热量,则甲烷燃烧热的热化学方为