题目内容
【题目】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)![]() 2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是
2HI(g)。已知H2和I2的起始浓度均为0.10 mol/L,达平衡时HI的浓度为0.16 mol/L。若H2和I2的起始浓度均变为0.20 mol/L时,则平衡时H2的浓度(mol/L)是
A. 0.16 B. 0.08 C. 0.06 D. 0.04
【答案】D
【解析】
H2(g) + I2(g)![]() 2HI(g)
2HI(g)
起始浓度 0.10 mol/L 0.10 mol/L 0
反应浓度 0.08 mol/L 0.08 mol/L 0.16 mol/L
平衡浓度 0.02 mol/L 0.02 mol/L 0.16 mol/L
化学平衡常数K=c2(HI)/c(H2)![]() c(I2)= 0.16/0.02
c(I2)= 0.16/0.02![]() 0.02 =64 ;当 H2和I2的起始浓度均变为0.20 mol/L时,设则平衡时H2的浓度为x mol/L ,则氢气的反应浓度为(0.20 –x)mol/L .
0.02 =64 ;当 H2和I2的起始浓度均变为0.20 mol/L时,设则平衡时H2的浓度为x mol/L ,则氢气的反应浓度为(0.20 –x)mol/L .
H2(g) + I2(g)![]() 2HI(g)
2HI(g)
起始浓度0.20 mol/L 0.20 mol/L 0
反应浓度 (0.20 –x)mol/L(0.20 –x)mol/L 2(0.20 –x)mol/L
平衡浓度x x2(0.20 –x)mol/L
化学平衡常数k=2(0.20 –x)2/x2=64, 计算得出x=0.04 mol/L 所以D选项符合题意;故D正确。

【题目】第三代半导体材料氮化镓(GaN)适合于制作高温、高频、抗辐射及大功率器件,通常称为高温半导体材料。回答下列问题:
(1)基态Ga原子价层电子的轨道表达式为_________________________,第一电离能介于N和B之间的第二周期元素有_______种。
(2)HCN分子中σ键与π键的数目之比为_______,其中σ键的对称方式为___________。与CN—互为等电子体的分子为___________。
(3)NaN3是汽车安全气囊中的主要化学成分,其中阴离子中心原子的杂化轨道类型为_________。NF3的空间构型为____________。
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因_________________________________________________________。
GaN | GaP | GaAs | |
熔点 | 1700℃ | 1480℃ | 1238℃ |
(5)GaN晶胞结构如下图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。


① 晶胞中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____________;
② GaN的密度为______________________g·cm3(用a、NA表示)。
【题目】一定温度下,在三个容积均为 1.0 L 的恒容密闭容器中发生反应:CH3OH(g)+CO(g) CH3COOH(g) ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器 I 与容器 II 中的总压强之比为 3 : 4
B. 达平衡时,容器 II 中 ![]() 比容器 I 中的小
比容器 I 中的小
C. 达平衡时,容器Ⅲ中的正反应速率比容器 I 中的大
D. 达平衡时,容器 I 中CH3OH 转化率与容器 III 中 CH3COOH 转化率之和小于 1
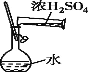
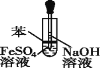
【题目】下列实验方案合理的是( )
|
|
|
|
A.制取少量CO2,可随开随制,随关随停 | B.配制一定物质的量浓度的稀硫酸 | C.可制得Fe(OH)2,并观察其颜色 | D. 干燥、收集NH3,并吸收多余的尾气 |
A. AB. BC. CD. D