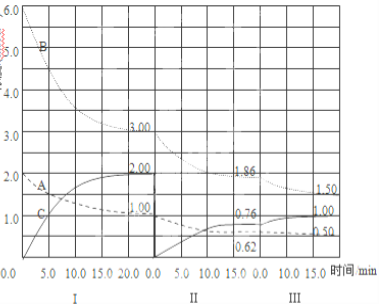
题目内容
【题目】常温下若NH4Cl 溶液中c(NH4Cl)<0.1 mol·L-1,则pH>5.1。现用0.1 mol·L-1盐酸滴定10 mL 0.05 mol·L-1氨水,甲基橙作指示剂,达到终点时所用盐酸的量应是
A.10 mL B.大于5 mL C.5 mL D.小于5 mL
【答案】B
【解析】
试题分析:按照酸碱恰好中和反应:HCl+NH3H20=NH4Cl+H20进行计算,可知需消耗盐酸体积为5ml,依据题干信息可知,此时溶液PH值大于5.1,而甲基橙的变色范围在3.1-4.4范围,不变色,故应继续向其中滴加盐酸方可发生变色,所以终点时所用盐酸的量应大于5mL,故选B。

练习册系列答案
相关题目