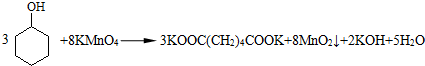题目内容
(6分)4.35 g二氧化锰能与浓盐酸(密度为1.19 g·cm-3、质量分数为36.5%)完全反应。求:
(1)盐酸中HCl的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)将所得气体全部用石灰乳吸收,可得到漂白粉的质量。
【答案】
(1)11.9mol/L (2)0.1mol (3)6.35g (每小题2分,共6分)
【解析】
试题分析:(1)根据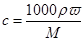 可知
可知
盐酸中HCl的物质的量浓度是
(2)4.35g二氧化锰的物质的量是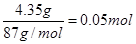
则根据反应的化学方程式可知
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
1mol 4mol 1mol
0.05mol 0.2mol 0.05mol
即生成氯气是0.05mol
而被氧化的氯化氢则是0.2mol÷2=0.1mol
(3)根据制备漂白粉的方程式可知
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 254g
0.05mol 6.35g
即漂白粉的质量是6.35g
考点:考查物质的量浓度的计算、氧化还原反应的计算以及漂白粉的制备
点评:该题是基础性试题的考查,试题难易适中,属于中等难度的试题。该题需要注意的是分清楚被氧化的氯化氢还是常见反应的氯化氢,以及漂白粉的组成等。该题有利于培养学生的规范答题能力,以及灵活运用基础知识解决实际问题的能力。

练习册系列答案
相关题目
 (2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下:
(2012?南京模拟)己二酸是合成尼龙-66的主要原料之一.实验室用高锰酸钾氧化环己醇制己二酸的装置如图所示(加热、搅拌和仪器固定装置均已略去).实验过程如下: