题目内容
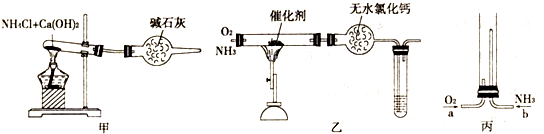
资料显示:“氨气可在纯氧中安静燃烧,并生成无污染的产物……”。某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是________;碱石灰的作用是__________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是____________________________________;试管内气体变为红棕色,该反应的化学方程式是_________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:氨气安静燃烧的化学方程式是___________________。
(8分,方程式每条2分,其余每空一分)(1)(NH4)2CO3 吸收CO2和水蒸气
(2)4NH3 + 5O2  4NO + 6H2O ;2NO + O2= 2NO2
4NO + 6H2O ;2NO + O2= 2NO2
(3) 4NH3 + 3O2 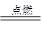 2N2 + 6H2O
2N2 + 6H2O
解析试题分析:(1)弱酸的铵盐加热分解易生成氨气,所以大试管内碳酸盐的化学式是(NH4)2CO3。碳酸铵在加热的条件下生成氨气和水和二氧化碳,用装置A制取纯净、干燥的氨气,就需要把水和二氧化碳除去,碱石灰的作用是:吸收生成的CO2、H2O,得到干燥的氨气。
(2)在催化剂的作用下,氨气被氧气氧化生成NO和水,则反应的化学方程式是4NH3 + 5O2  4NO + 6H2O。生成的NO极易被氧化生成红棕色的NO2,则该反应的化学方程式是2NO + O2= 2NO2。
4NO + 6H2O。生成的NO极易被氧化生成红棕色的NO2,则该反应的化学方程式是2NO + O2= 2NO2。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,氨气燃烧生成氮气和水,反应的化学方程式是4NH3 + 3O2 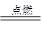 2N2 + 6H2O。
2N2 + 6H2O。
考点:考查氨气的制备、氨气性质的实验探究
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。