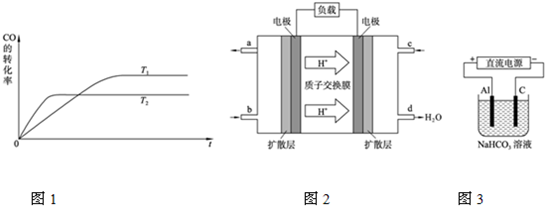
题目内容
(平行班做)常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
【答案】
D
【解析】

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(平行班做)常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
| A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |