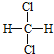
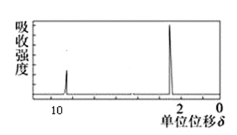
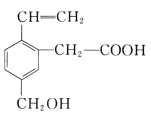
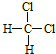题目内容
【题目】常温下,下列性质不能证明乙酸是弱电解质的是
A.0.1mol/L乙酸溶液的![]()
B.![]() 溶液的
溶液的![]()
C.将0.1mol/L乙酸溶液稀释100倍,pH变化<2
D.乙酸溶液的导电性比盐酸溶液的导电性弱
【答案】D
【解析】
A. 0.1molL-1的乙酸溶液的![]() ,即c(H+)小于0.1molL-1,说明乙酸不能完全电离,可以证明是弱电解质,A项正确;
,即c(H+)小于0.1molL-1,说明乙酸不能完全电离,可以证明是弱电解质,A项正确;
B. ![]() 溶液的
溶液的![]() ,说明CH3COO-会水解,则证明CH3COOH为弱电解质,B项正确;
,说明CH3COO-会水解,则证明CH3COOH为弱电解质,B项正确;
C. 将0.1 mol/L乙酸溶液稀释100倍,pH变化<2,则说明加水促进其电离,即能证明CH3COOH为弱电解质,C项正确;
D. 未注明是否是在相同条件下测的溶液导电性,因此无法证明乙酸是弱电解质,D项错误;
答案选D。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
| ① | 0.2molL-1盐酸 | 产生黄绿色气体 |
② | 0.2molL-1KI-淀粉溶液 | 溶液变蓝 | |
③ | 0.2molL-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
④ | 0.2molL-1AlCl3溶液 | 产生白色沉淀 | |
下列判断不正确的是
A.实验①中发生的反应:ClO-+Cl-+2H+=Cl2↑+H2O
B.实验②中发生的反应:ClO-+2I-+2H+=Cl-+I2+H2O
C.实验③中该条件下氧化性强弱:ClO->Fe3+
D.实验④中ClO-与Al3+相互促进水解
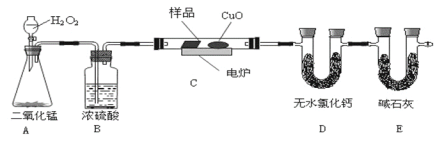
【题目】实验室制备1,2-二溴乙烷的实验流程如下:
![]()
已知:①主要副反应:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
②有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
溶解性 | 易溶于水 | 难溶于水 | 难溶于水 |
沸点/℃ | 78.5 | 132 | 34.6 |
试回答下列问题:
(1)乙醇与浓硫酸l70℃发生反应的化学方程式:______________________。
(2)乙醇与浓硫酸反应装置中放入几片碎瓷片,目的是_________________________。
(3)反应得到的混合气体中含有SO2、CO2等气体,检验其中的SO2气体可选用的试剂是_______________________________。
(4)吸收步骤中,应适当降低吸收液的温度,其主要目的是______________。
(5)实验制得的1,2-二溴乙烷粗产品中含有少量未反应的Br2和少量副产品乙醚,某同学进一步提纯如下:
序号 | 实验方案 | 实验目的或结论 |
① | 除去粗产品中少量未反应的Br2,实验方法是_________________ | 除去溴杂质 |
② | 除去粗产品中的乙醚的实验方法是将①实验后的有机混合物进行________________________ | 除去乙醚杂质 |