题目内容
研究和开发CO2和CO的创 新利用是环境保护和资源利用双赢的课题。
新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目


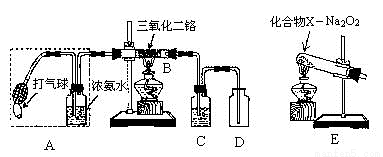
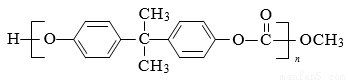 。一种生产 PC 的合成路线如下:
。一种生产 PC 的合成路线如下: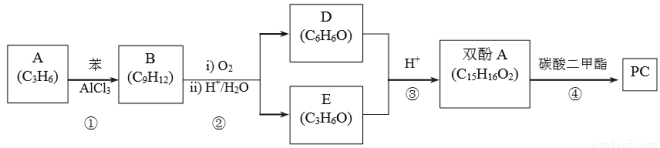
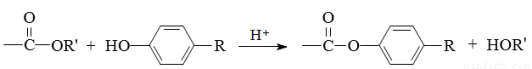

 液pH大小顺序:③>④>①>②
液pH大小顺序:③>④>①>② MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求: