��Ŀ����
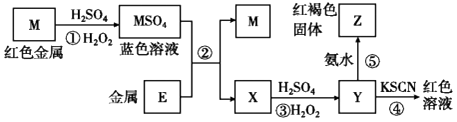
����Ŀ��̼��þˮ�������Ʊ�þ��Ʒ���м��壬��ҵ�ϴ�������±ˮ����Ҫ�ɷ�ΪMgCl2���л�ȡMgCO33H2O�ķ�����ͼ1�� 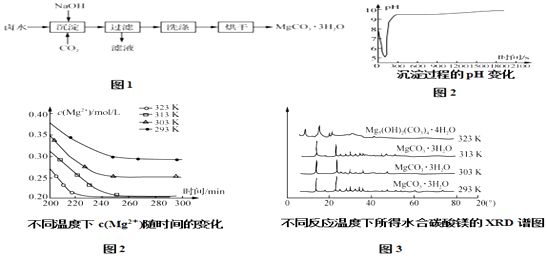
��1��д���������̵����ӷ���ʽ��
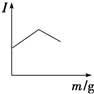
��2���������̵�pH��ʱ��ı仯��ͼ2��ʾ���������̵IJ���Ϊ������ţ� a����±ˮ�еμ�NaOH��Һ��ͬʱͨ��CO2
b����NaOH��Һ�еμ�±ˮ��ͬʱͨ��CO2
c����±ˮ��ͨ��CO2�����ͣ�Ȼ��μ�NaOH��Һ��ͬʱ����ͨ��CO2
d����NaOH��Һ��ͨ��CO2�����ͣ�Ȼ��μ�±ˮ��ͬʱ����ͨ��CO2
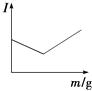
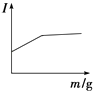
��3���������̵�c��Mg2+����ʱ��ı仯��ͼ3��ʾ����ͬ�¶������õ��ij���������ͼ4��ʾ����������Ӧѡ����¶�Ϊ �� �����ǣ� ��
��4����ϴ�Ӳ����У���������ϴ�Ӹɾ��IJ���Ϊ�� ��
���𰸡�
��1��Mg2++CO2+2OH��+2H2O�TMgCO3?3H2O��
��2��c
��3��313K���ϸߵ��¶��ܹ��ӿ������Ӧ�����ʣ�Ҳʹ����Һ�в�����c��Mg2+����С�����Mg2+�ij����ʣ����¶ȹ���������Mg5��OH��2��CO3��4?4H2O
��4��ȡ���һ��ϴ����Һ�������м���HNO3�ữ��AgNO3��Һ�����ް�ɫ�������ɣ�����ϴ�Ӹɾ�
���������⣺��1����������������MgCO33H2O������Ӧ�����ӷ���ʽΪMg2++CO2+2OH��+2H2O�TMgCO33H2O���� ���Դ��ǣ�Mg2++CO2+2OH��+2H2O�TMgCO33H2O������2������ͼ1��֪���������̵�pH��ʱ��ı仯���ȱ�С������Ȼ����9��10֮�����ң�����Һ��ʼ��PHֵ��7��8���ң����Գ������̵IJ���Ϊ��±ˮ��ͨ��CO2�����ͣ�Ȼ��μ�NaOH��Һ��ͬʱ����ͨ��CO2 �� ��ѡc����3������ͼ2��֪���ϸߵ��¶��ܹ��ӿ������Ӧ�����ʣ�Ҳʹ����Һ�в�����c��Mg2+����С������ͼ3��֪��323Kʱ��Mg2+����Mg5��OH��2��CO3��44H2O����������ѡ����¶�Ϊ313K�������ǽϸߵ��¶��ܹ��ӿ������Ӧ�����ʣ�Ҳʹ����Һ�в�����c��Mg2+����С�����Mg2+�ij����ʣ����¶ȹ���������Mg5��OH��2��CO3��44H2O��
���Դ��ǣ�313K���ϸߵ��¶��ܹ��ӿ������Ӧ�����ʣ�Ҳʹ����Һ�в�����c��Mg2+����С�����Mg2+�ij����ʣ����¶ȹ���������Mg5��OH��2��CO3��44H2O��4����ϴ�Ӳ����У������ǴӺ��������ӵ���Һ�������ģ����Կ���ͨ�������������жϲ���ϴ���Ƿ�ɾ������Ա�������ϴ�Ӹɾ��IJ���Ϊȡ���һ��ϴ����Һ�������м���HNO3�ữ��AgNO3��Һ�����ް�ɫ�������ɣ�����ϴ�Ӹɾ���
���Դ��ǣ�ȡ���һ��ϴ����Һ�������м���HNO3�ữ��AgNO3��Һ�����ް�ɫ�������ɣ�����ϴ�Ӹɾ���