题目内容
【题目】某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如图:
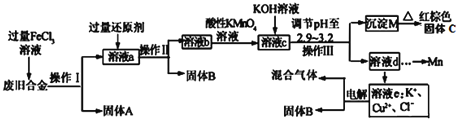
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________,溶液a中发生的反应的离子方程式为________;
(3)将溶液c调节pH至2.9~3.2的目的是________;
(4)常温下,取2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________;
(5)工业上由红棕色固体C制取相应单质常用的方法是________。
A.电解法 B.热还原法 C.热分解法
(6)用惰性电极电解溶液e制取固体B,阳极主要发生的电极反应为______________。
【答案】D Cu ![]() 使Fe3+完全沉淀,同时避免Cu2+等其他金属阳离子沉淀 4 B
使Fe3+完全沉淀,同时避免Cu2+等其他金属阳离子沉淀 4 B ![]()
【解析】
废旧合金中含有Fe,Cu和Si三种成分,最终要实现分离和回收;第一步向废旧合金中加过量的FeCl3,Si无法反应,Fe和Cu则会被溶解;因此固体A即未反应的Si,溶液a中则含有Fe2+,Cu2+以及未消耗完的Fe3+;那么第二步中加还原剂则是为了去除Fe3+,为了不引入新的杂质,可能的选择为Fe粉或Cu粉;又因为,溶液e中含有Cu2+,而加入过量的Fe粉会使Cu2+被还原为单质,因此还原剂应选择铜粉;因此固体B即未反应完的铜粉,溶液b中则含有Fe2+,Cu2+;溶液b中加酸性高锰酸钾溶液,可以将Fe2+转变为Fe3+,调节pH值时就可将Fe3+从溶液中沉淀除去,同时又可避免Cu2+在这一步中沉淀;脱除溶液d中的Mn元素后,溶液e中的所有离子仅剩Cu2+,K+和Cl-,再对其进行电解处理即可得到铜单质以及其他产物。
(1)操作Ⅰ,Ⅱ,Ⅲ都是分离溶液和固体的操作,除过滤外还会涉及洗涤和干燥的步骤;蒸馏是用来分离液体互溶的体系,因此上述操作中一定不涉及蒸馏;
(2)通过分析可知,还原剂应当选择铜粉,利用铜粉将第一步中剩余的Fe3+除去;相关的离子方程式为:![]() ;
;
(3)由题可知,常温下![]() ,
,![]() ,
,![]() ,因此同等浓度下溶液中Fe3+先发生沉淀,后续是Cu2+,最后时候Mn2+,因此调节pH值在2.9至3.2,目的是使Fe3+沉淀完全的同时避免Cu2+等其他金属离子发生沉淀;
,因此同等浓度下溶液中Fe3+先发生沉淀,后续是Cu2+,最后时候Mn2+,因此调节pH值在2.9至3.2,目的是使Fe3+沉淀完全的同时避免Cu2+等其他金属离子发生沉淀;
(4)由题可知,常温下![]() ,铜离子浓度为2mol/L时,若要开始生成Cu(OH)2沉淀,OH-的浓度至少为10-10mol/L,即pH至少为4;
,铜离子浓度为2mol/L时,若要开始生成Cu(OH)2沉淀,OH-的浓度至少为10-10mol/L,即pH至少为4;
(5)通过分析可知,红棕色固体C即为Fe2O3,由其获取Fe单质,采用的是热还原法;
(6)溶液中含有Cl-,因此惰性电极电解该溶液时,阳极发生的是Cl-的氧化反应,电极反应为:![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】下表中各组物质之间不能通过一步反应实现如图的是( )
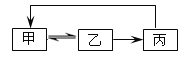
甲 | 乙 | 丙 | |
A | NaHCO3 | Na2CO3 | NaCl |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |
A.AB.BC.CD.D