题目内容
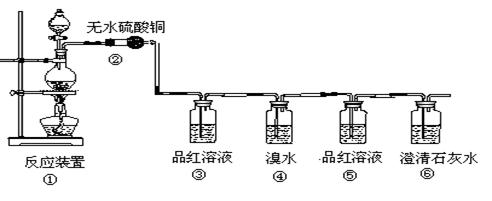
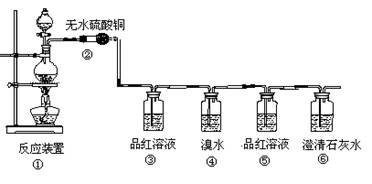
(16分)现欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物。有一个同学按气体的流动方向设计了一个实验流程,其所使用的试剂次序可表示为:气体产物→无水硫酸铜→品红溶液→溴水→品红溶液→澄清石灰水
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答:
。
(2)①中反应的化学方程为 ;
(3)②处的现象是: 。
(4)品红溶液使用了两次,第二次使用时的作用是________________ 。
(5)④二氧化硫表现了二氧化硫的 性。(“还原”、“漂白”)
反应的化学方程式为: 。
(6)根据 现象,可证明产物中一定有CO2气体。
(16分)
⑴ 反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。 (2分)
⑵ C + 2H2SO4(浓) CO2↑+2SO2↑+ 2H2O (3分)
⑶ 白色固体变蓝色 (2分)
⑷ 检验SO2是否除净 (2分)
⑸ 漂白 (2分) SO2 + Br2+ 2H2O == H2SO4 + 2HBr (3分)
⑹ 第二次品红溶液不褪色,澄清石灰水变浑浊 (2分)
解析:

 漏气。
漏气。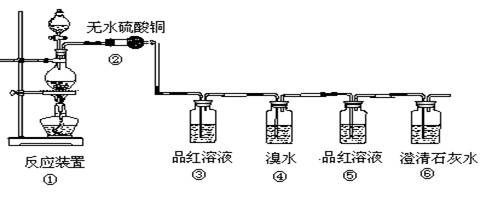
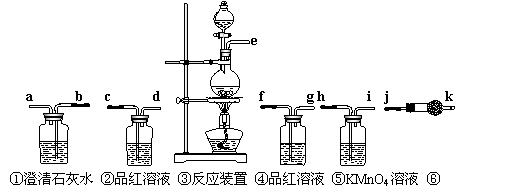 (6)写出气体产物最后与澄清石灰水反应的离子方程式:__________________________________________。
(6)写出气体产物最后与澄清石灰水反应的离子方程式:__________________________________________。