题目内容
(6分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1 mol产物的数据)。

根据上图回答下列问题:
(1)PCl3分解成P(s)和Cl2(g)的热化学方程式是__________________________________。
(2)P和Cl2分两步反应生成1 mol PCl5的△H1=_______________,与P和Cl2一步反应生成1 mol PCl5的△H2的关系是:△H2__________△H1(填“大于”、“小于”或“等于”)。

根据上图回答下列问题:
(1)PCl3分解成P(s)和Cl2(g)的热化学方程式是__________________________________。
(2)P和Cl2分两步反应生成1 mol PCl5的△H1=_______________,与P和Cl2一步反应生成1 mol PCl5的△H2的关系是:△H2__________△H1(填“大于”、“小于”或“等于”)。
(1)2PCl3 (g) =" 3" Cl2 (g)+ 2P(s) ΔH=+612 kJ·mol-1
(2)-399 kJ·mol-1 等于
(2)-399 kJ·mol-1 等于
(1)由图像可知P(s)和Cl2(g)的总能量高于PCl3(g),所以PCl3分解成P(s)和Cl2(g)的反应是吸热反应。因为每生成1mol PCl3(g),反应放出306kJ能量,故分解的热化学方程式为2PCl3 (g) =" 3" Cl2 (g)+ 2P(s) ΔH=+612 kJ·mol-1。
(2)根据图像可写出PCl3(g)和Cl2(g)反应生成1mol PCl5(g)的热化学方程式PCl3(g)+Cl2(g)反=PCl5(g) ΔH=-93 kJ·mol-1。所以根据盖斯定律知,将反应①2PCl3 (g) =" 3" Cl2 (g)+ 2P(s) ΔH=+612 kJ·mol-1和反应②PCl3(g)+Cl2(g)反=PCl5(g) ΔH=-93 kJ·mol-1叠加,即②-①÷2得到P(s)+5/2Cl2(g)反=PCl5(g),所以△H=-399 kJ·mol-1。反应热只与物质的始态和终态有关,而与反应过程无关,即△H2等于△H1。
(2)根据图像可写出PCl3(g)和Cl2(g)反应生成1mol PCl5(g)的热化学方程式PCl3(g)+Cl2(g)反=PCl5(g) ΔH=-93 kJ·mol-1。所以根据盖斯定律知,将反应①2PCl3 (g) =" 3" Cl2 (g)+ 2P(s) ΔH=+612 kJ·mol-1和反应②PCl3(g)+Cl2(g)反=PCl5(g) ΔH=-93 kJ·mol-1叠加,即②-①÷2得到P(s)+5/2Cl2(g)反=PCl5(g),所以△H=-399 kJ·mol-1。反应热只与物质的始态和终态有关,而与反应过程无关,即△H2等于△H1。

练习册系列答案
相关题目
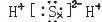
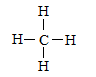 ,是对称的平面结构
,是对称的平面结构