��Ŀ����
���Ǵ���������������ҪԪ��֮һ���Ӵ�ͳ���ϵ���Ϣ���ϵķ�չ�����д�����һ����һ���漣��
��1������Ԫ�����ڱ��е�λ����_______��
��2����ҵ�����ֹ�ķ�Ӧ�У�SiO2+2C Si���֣�+2CO����SiO2+3C
Si���֣�+2CO����SiO2+3C SiC+2CO��������Ʒ�е��ʹ���̼��������ʵ���֮��Ϊ1��1����μӷ�Ӧ��C��SiO2������֮��Ϊ
��
SiC+2CO��������Ʒ�е��ʹ���̼��������ʵ���֮��Ϊ1��1����μӷ�Ӧ��C��SiO2������֮��Ϊ
��
��3����ҵ�Ͽ���ͨ������ͼ��ʾ��������ȡ���裺

������ӦIΪ
Si���֣�+3HCl SiHCl3+H2��
SiHCl3+H2��
��ӦII�Ļ�ѧ����ʽΪ ��
�������Ʊ����̱����ϸ������ˮ������SiHCl3��ˮ���ҷ�Ӧ����H2SiO3��HCl���� һ�����ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
�ۼ���ÿһ�ִ��Ʊ�1mol���裬�����������й�Ԫ��û����ʧ����ӦI��HCl��������Ϊ90%����ӦII��H2��������Ϊ93.75%�����ڵڶ��ִε������У�����Ͷ��HCl ��H2�����ʵ���֮���� ��
��1����������IVA�� ��2��1:2
��3����SiHCl3+H2 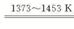 Si������+3HCl
Si������+3HCl
��SiHCl3+3H2O = H2SiO3+3HCl+H2��
��5:1
��������
�����������1���������ڱ���λ�ڵ������ڵ�IVA�塣
��2����������ʽ���ӣ���֪C��SiO2�����ʵ���֮��Ϊ5:2�����������Ϊ����5��12������2��60��=1:2��
��3����������ͼ��֪��ӦII��SiHCl3��H2��Ӧ���ɴ����HCl����˷���ʽΪ��SiHCl3+H2 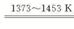 Si������+3HCl��
Si������+3HCl��
��д������ʽ����֪���ʣ�SiHCl3+3H2O �� H2SiO3+3HCl����ԭ���غ��֪��һ������ΪH2���ʷ���ʽΪSiHCl3+3H2O = H2SiO3+3HCl+H2����
��������������֪��
Si���֣�+ 3HCl 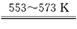 SiHCl3
+ H2
SiHCl3
+ H2
1mol 3mol 1mol
SiHCl3+H2 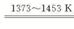 Si������+3HCl
Si������+3HCl
1mol 1mol 3mol
���������ݣ�ѭ��������ֻ�ܲ���3molHCl����HCl����������90%�������Ҫ���ӣ� ��molHCl��ѭ��������ֻ����1molH2����H2��������Ϊ93.75%����������ӣ�
��molHCl��ѭ��������ֻ����1molH2����H2��������Ϊ93.75%����������ӣ�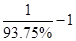 ��molH2����ˣ�����Ͷ��HCl ��H2�����ʵ���֮��Ϊ����
��molH2����ˣ�����Ͷ��HCl ��H2�����ʵ���֮��Ϊ���� ������
������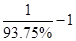 ��=5:1��
��=5:1��
���㣺����Ԫ�����ڱ�������ʽ��д�����ݷ���ʽ�ļ��㡣

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�