题目内容
5.加热下列溶液,其pH值不变的是( )(假设溶液的体积不变)| A. | 稀H2SO4 | B. | 醋酸溶液 | C. | NaCl溶液 | D. | FeCl3溶液 |
分析 根据溶液的pH=-lgc(H+)来分析.
A、稀硫酸溶液中,氢离子几乎全部来自于硫酸;
B、醋酸是弱电解质,加热促进其电离;
C、氯化钠溶液中的氢离子全部来自于水;
D、盐类的水解吸热.
解答 解:溶液的pH=-lgc(H+).要使溶液的pH不变,则氢离子浓度不变.
A、稀硫酸溶液中,氢离子几乎全部来自于硫酸,且硫酸是强电解质,已经完全电离,且为不挥发性酸,故升高温度,其溶液中的c(H+)不变,则pH不变,故A正确;
B、醋酸是弱电解质,而弱电解质的电离吸热,故加热促进其电离,导致溶液中的c(H+)升高,pH变小,故B错误;
C、氯化钠溶液中的氢离子全部来自于水,而水是弱电解质,升温促进水的电离,导致溶液中的c(H+)升高,pH变小,故C错误;
D、盐类的水解吸热,故升温促进其水解,导致溶液中的c(H+)升高,pH变小,故D错误;
故选A.
点评 本题考查了升高温度对溶液pH的影响,把握住溶液中氢离子的来源,然后通过升温对溶液中平衡的影响来分析,难度不大.

练习册系列答案
相关题目
16.NA为阿伏加德罗常数,下列叙述错误的是( )
| A. | 18 g H2O中含有的质子数为10NA | |
| B. | 17g NH4+中含有的质子数为11NA | |
| C. | 46 g NO2和N2O4混合气体中含有的原子总数为3 NA | |
| D. | 1mol Na与足量的O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
13.下列各种试纸,使用时预先不能用蒸馏水湿润的是( )
| A. | 红色石蕊试纸 | B. | 淀粉KI试纸 | C. | pH试纸 | D. | 蓝色石蕊试纸 |
20.已知溴酸银的溶解是吸热过程,在不同温度下溴酸银溶解平衡曲线如图所示,下列说法正确的是( )


| A. | T1>T2 | |
| B. | 加入AgNO3固体,可使a点变到c点 | |
| C. | a点和b点的Ksp相等 | |
| D. | c点时,在T1、T2两个温度下均有固体析出 |
10.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟甲基(-CH2OH)和甲氧基(-OCH3) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2-) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟基(-OH)和氢氧根(OH-) |
17.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 含1 mol H2SO4的浓硫酸与足量铜反应转移的电子总数为NA | |
| B. | 标准状况下,22.4 L O2 作氧化剂时转移电子数一定为4NA | |
| C. | 10 L 0.1 mol/L 的Na2CO3溶液中,Na+、CO32-总数为3NA | |
| D. | 通常状况下,4.2 g丙烯中所含碳氢键数目为0.6 NA |
14.COCl2(g)?CO(g)+Cl2(g)△H>0.当反应达到平衡时,下列措施:
①升温;②恒压通入惰性气体;③增加CO的浓度;④加催化剂;⑤减压;⑥恒容通入惰性气体.能提高COCl2转化率的是( )
①升温;②恒压通入惰性气体;③增加CO的浓度;④加催化剂;⑤减压;⑥恒容通入惰性气体.能提高COCl2转化率的是( )
| A. | ①④⑥ | B. | ①②⑤ | C. | ②③⑥ | D. | ③⑤⑥ |
15.已知某主族元素的原子结构示意图如下,判断其位于第几周期,第几族( )

| A. | 四、IIA族,四、VIIA 族 | B. | 四、IA族,五、VIIA族 | ||
| C. | 四、IIA族,五、VIA族 | D. | 五、IA族,五、VIIA族 |
 $→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$
$→_{催化剂.△}^{RCH_{2}C-O-CCH_{2}R}$ (R=CCOOH(R=-CH3或-H)
(R=CCOOH(R=-CH3或-H) $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$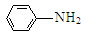
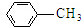 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$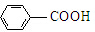
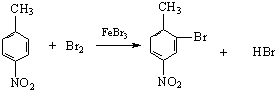 .
.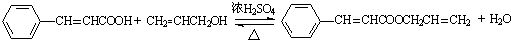 .
.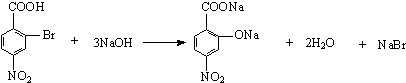 .
.