题目内容
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
下列说法不正确的是
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
2N2O5(g)
 4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
A.500 s内N2O5分解速率为2.96×10-3 mol·(L·s)-1
B.T1温度下的平衡常数为K1=125, 1000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
C
A、500 s内N2O5分解速率=(5.00-3.52)mol·L-1/500 s=2.96×10-3 mol·(L·s)-1,故正确;
B、分析表中数据,得:1000 s时达平衡; 2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)C(初始) 5.00 0 0
△C 2.50 5.00 1.25
C(平衡)2.50 5.00 1.25
K1=([NO2]4[O2])/[ N2O5]2 ,代入数据,得:K1=125
1000 s时转化率="2.50/5.00=50%" ,故正确;
C、T1温度下反应到1000 s时测得N2O5(g)浓度为2.50 mol·L-1,
T2温度下反应到1000 s时测得N2O5(g)浓度为2.98 mol·L-1,
即:T1到T2,N2O5(g)浓度的增大,平衡逆向移动,逆向为放热的,则T1>T2,故错误;
D、K1>K3,说明(T1到T3)K值减小,平衡逆向移动,逆向为放热的,则T1>T3,故正确

练习册系列答案
相关题目
 2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是( )
2C(g)若经2 s 后测得C的浓度为0.6 mol/L,下列几种说法正确的是( ) 2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示: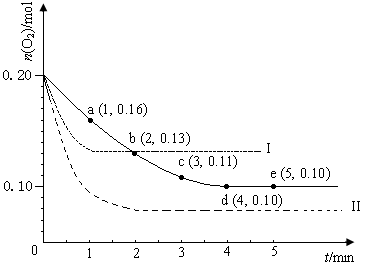
 Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示:
Si(s)+4HCl(g)。已知SiCl4可完全水解生成硅酸和盐酸。向容积为1L的密闭容器中充入一定量的SiCl4(g)和H2(g),分别在T1和T2温度时进行反应。SiCl4的物质的量随时间变化情况如下表所示: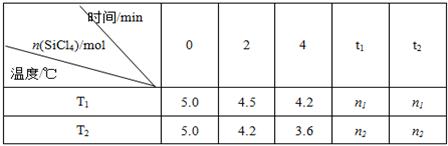
 2Z(g)+2Q(s)
2Z(g)+2Q(s) 2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是
2SCl2(鲜红色液体)DH=-61.16kJ·mol-1。下列说法正确的是 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )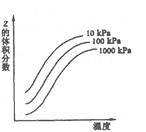
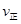 增大,
增大,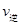 减小,平衡向右移动
减小,平衡向右移动 p C(g),达到平衡时,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B的浓度为原来的2.5倍,下列说法正确的是( )
p C(g),达到平衡时,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B的浓度为原来的2.5倍,下列说法正确的是( )