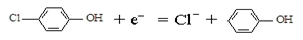题目内容
氮元素可以形成多种化合物。回答下列问题:
(1)基态氮原子的价电子排布式是____;C、N、O 三种元素电负性从小到大的顺序是________。
(2)肼(N2H4)分子中氮原子轨道的杂化类型是______;肼可用作火箭燃料,燃烧时发生的反应时N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=11038.7kJ·mol-1,若该反应中8molN-H键断裂,则形成的σ键有____mol;肼能与硫酸反应生成N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在______(填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)氨是________(填“极性”或“非极性”)分子;氨的沸点高于膦(PH3)的原因是________。
(4)将氨气通入硫酸铜水溶液中形成[Cu(NH3)4]SO4深蓝色溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______。
(5)单质铜和镍都是由金属键形成的晶体,元素铜和镍的第二电离能分别为:ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi的原因是_______。某镍白铜合金的立方晶胞结构如图所示。晶胞中镍原子与铜原子的个数比为_______。若合金的密度为dg/cm3,晶胞参数a=_________nm。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


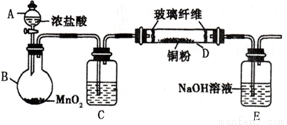
 CO+H2的反应类型是
CO+H2的反应类型是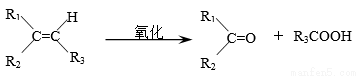

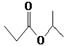 D. 丙醛的结构简式:CH3CH2COH
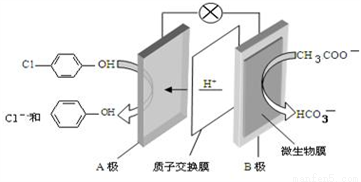
D. 丙醛的结构简式:CH3CH2COH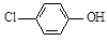 ),其原理如图所示,下列说法正确的是
),其原理如图所示,下列说法正确的是