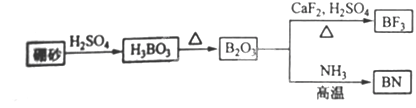
题目内容
(12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、 B、 C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是 ,由非极性键形成的非极性分子是 ,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式 ,属于原子晶体的是 ,四种物质熔点由高到低的顺序是 。
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、 B、 C、
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是 ,由非极性键形成的非极性分子是 ,能形成分子晶体的化合物是 ,含有氢键的晶体的化学式 ,属于原子晶体的是 ,四种物质熔点由高到低的顺序是 。
(1)A、金属晶体 B、分子晶体 C、原子晶体
(2)Co3+ CN- 6 (3)CO2, H2, CO2 HF , HF , SiC , SiC HF CO2 H2
(2)Co3+ CN- 6 (3)CO2, H2, CO2 HF , HF , SiC , SiC HF CO2 H2
本题考查物质结构及性质。(1)固态能导电只有金属晶体,因为其中含有自由移动的电子,离子晶体在溶液和熔融状态下可以导电,C熔点高,故为原子晶体,根据相似相溶原理B为非极性分子,为分子晶体。(2)配位化合物中,一般过渡金属为中心原子,CN-为配体,配位数为6。(3)共用电子对的为同一元素的为非极性键,不同元素的为极性键,而分子的极性要看分子对称情况等,H2为非极性键组成的非极性分子,SiC为极性键组成的原子晶体,CO2为极性键组成分非极性分子(直线型),HF为极性键组成的非极性分子,熔沸点高低:原子晶体>离子晶体>分子晶体,分子晶体:①氢键的存在,②分子间作用力(结构相似,相对分子质量越大,作用力越大,熔沸点越高)故有SiC>HF>CO2>H2

练习册系列答案
相关题目